已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法不正确的是( )
A.原子半径:Z>W>R
B.对应氢化物的稳定性:R>W
C.W与X、W与Z形成的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
【答案】分析:已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价绝对值相等,Y最外层电子数为4,Z的核电荷数是Y的2倍,故Y为C元素,Z为Mg元素;W的原子序数等于Mg元素,W最外层电子数是最内层电子数的3倍,则W的最外层电子数为6,故W为S元素,所以R为Cl元素.结合元素周期律与物质的结构性质判断.
解答:解:已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,则X为H元素;Y元素的最高正价与最低负价绝对值相等,Y最外层电子数为4,Z的核电荷数是Y的2倍,故Y为C元素,Z为Mg元素;W的原子序数等于Mg元素,W最外层电子数是最内层电子数的3倍,则W的最外层电子数为6,故W为S元素,所以R为Cl元素.
A、Z为Mg元素、W为S元素、R为Cl元素,同周期从左向右原子半径在减小,则原子半径为Z>W>R,故A正确;
B、W为S元素、R为Cl元素,非金属性Cl>S,非金属性越强,氢化物的稳定性越强,所以对应氢化物的稳定性:R>W,故B正确;
C、W与X形成物质为H2S,属于共价化合物,含有共价键,W与Z形成的物质是MgS,属于离子化合物,胡离子键,化学键类型不同,故C错误;
D、Y为C元素,其最高价氧化物对应的水化物是碳酸,碳酸属于弱酸,故D正确.
故选C.
点评:本题考查原子结构与位置关系、核外电子排布规律、元素周期律与元素化合物的结构性质等,难度不大,掌握金属性非金属性、最高价氧化物对应水化物的酸性的比较规律.









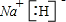
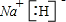
 、
、 、
、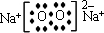
 、
、 、
、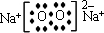
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )