


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�˹��ؽ�����ѧ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
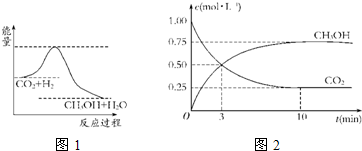
��10�֣���������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)+3H2(g)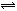 CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯��
CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯��
��1�����ڸ÷�Ӧ������˵���У���ȷ����_______��
A����H>0����S>0�� B����H>0����S<0��
C ����H<0����S<0�� D����H<0����S>0��
����H<0����S<0�� D����H<0����S>0��
��2����ͼ����������ߵ����͵�֮��IJ�ֵ����
��3��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2
��3mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2) _________mol��L-1��min-1��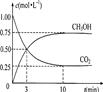
��4���£�N2H4����һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ������ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ�ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��̽���ѻ�������ֵ
��֪��
���� | CH4 | C2H6 | C2H4 | C3H6 |
ȼ����/kJ��mol-1 | Q1 | Q2 | Q3 | Q4 |
����448 L����״�����ѻ������ȼ�շų�����Q kJ����Q��ȡֵ��Χ���ڣ�______________________����Q1��Q2��Q3��Q4��ʾ����ͬ����
������448 L���壨��״��������ͨ��ʢ������������Ȼ�̼��Һ�У�����ϴ��ƿ����336 g����448 L����״����������ȫȼ�շų�������Q=_____________kJ��
��2��������H2�ӳɷ�Ӧ����������������������������ϵ
��ȡ�ѻ�����H2��ϵ�5 L������壬��֪����H2����������գ�H2��=X����һ��������ʹ���ַ�Ӧ����Ӧ����������ΪV L�����г�V��X�ĺ�����ϵʽ��___________________
______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����Ȼ�ѧ����ʽ��
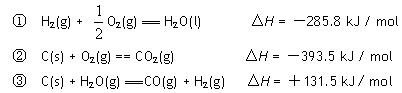
��ش�
��1��������Ӧ�����ڷ��ȷ�Ӧ���� ������ţ���ͬ�����������ȷ�Ӧ���� ��
��2��2mol̼��ȫȼ�շų�������Ϊ kJ��
��3��������ȼ���ȡ�H= kJ / mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��0101 ��ĩ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com