
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
分析 X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,
A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:Z>X>Y,故A正确;
B.Y为O,不存在最高正价,故B错误;
C.氯气与氢气发生反应生成HCl,HCl溶于水得到盐酸,则W的单质是工业制取盐酸的原料之一,故C正确;
D.X、W的氢化物分别为氨气、HCl,二者反应生成氯化铵,相遇会产生白烟,故D正确;
故选B.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意O不存在正价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N-2)}{A}$ mol | C. | $\frac{(A-N+2)}{Am}$ mol | D. | $\frac{m(A-N+2)}{A}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含非极性共价键 | |
| B. | 原子晶体的熔点一定高于其他晶体 | |
| C. | 金属晶体的堆积方式的空间利用率最低的是Po | |
| D. | 构成晶体的粒子一定含有化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
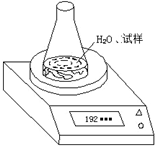
| 锥形瓶+水+试样 | |||||
| 读数次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 质量/g | 192.80 | 192.30 | 192.10 | 192.00 | 192.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
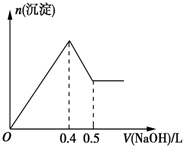 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com