
(17分)合成氨工业上常用下列方法制备H2 :
方法:
方法: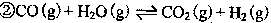
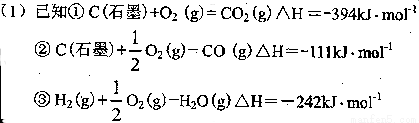
试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
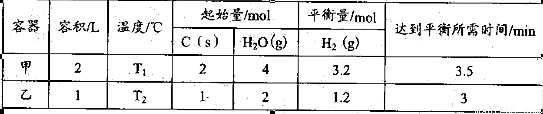
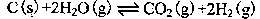 其相关数据如下表所示:
其相关数据如下表所示:
①T1_________T2 (填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K=_________ 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.
B.混合气体的密度保持不变

D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
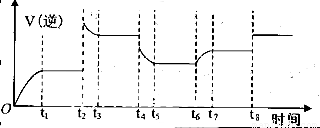
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
(17分)(1)20500kJ (2分)
(2)① > (2分) 12.8(2分)
② <1.4mol/L (2分)
③BD(选全得2分,漏选得1分,有错选0分)
④t7-t8 (或“t7到t8”)(2分) 降低温度(2分)
⑤ 2×10-9/(c-0.02) (3分)
【解析】
试题分析:(1)根据盖斯定律得由方法②制取氢气的热化学方程式可由已知中的反应得到,每生成1mol氢气放出的热量=①-②-③=(394-111-242)kJ=41kJ,1000g氢气的物质的量是500mol,所以制备l000g H2所放出的能量为500×41=20500kJ;
(2)①由表中数据可计算各物质的平衡浓度,所以T1的化学平衡常数K1=1.62×0.8/0.42=12.8,同理可计算T2的平衡常数K2=1.35,因为该反应是吸热反应,K1> K2,所以T1>T2
②反应进行到一半时,若按反应速率一直不变计算,1.5min时水蒸气的浓度是2mol/L-0.6mol/L=1.4mol/L,但是反应速率随反应的进行逐渐减小,前一半的反应速率大于后一半的反应速率,所以消耗水蒸气的浓度较大,则剩余水蒸气的浓度应小于1.4mol/L;
③A、平衡时氢气的正反应速率是二氧化碳逆反应速率的2倍,错误;B、该反应有固体参与,所以气体的质量一直在变,当达到平衡时气体的质量不再变化,容器的体积一直不变,所以当气体的密度不变时证明已达平衡状态,正确;C、气体的浓度之比符合化学计量数之比时 不能判断平衡是否到达,错误;D、混合气体的质量与气体的物质的量在未达平衡时一直在变,即气体的平均相对分子质量在变,平衡时混合气体的质量、物质的量均固定,混合气体的平均相对分子质量不再变化,正确,答案选BD;
④H2O (g)的平衡转化率最低,证明平衡一直逆向移动,t2~t4逆反应速率陡然增大后减小至不变,说明改变的一个条件是增大压强,平衡逆向移动;t4~t6逆反应速率陡然减小至不变,说明改变的条件是降低温度,平衡逆向移动;t6~t7逆反应速率先不变再逐渐增大至不变,说明改变的条件是又充入了水蒸气,虽然平衡正向移动,但水蒸气的转化率降低了,所以水蒸气的转化率最低的是t7-t8;t4时刻改变的条件是降低温度;
⑤混合溶液呈中性证明c(OH-)= c(H+)=1×10-7mol/L,根据电荷守恒得c(Na+)=c(CH3COO-)=0.01mol/L,因为醋酸钠溶液呈碱性,现在溶液呈中性,说明醋酸过量,所以剩余醋酸的物质的量浓度是(c-0.02)/2mol/L,则产生的电离平衡常数K= c(H+) c(CH3COO-)/ c(CH3COOH)= 2×10-9/(c-0.02)。
考点:考查化学平衡状态的判断,转化率的判断,对图像的分析,反应热效应的计算,混合溶液的计算


科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3△2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:简答题
(16分)脱水偶联反应是一种新型的直接烷基化反应,例如:
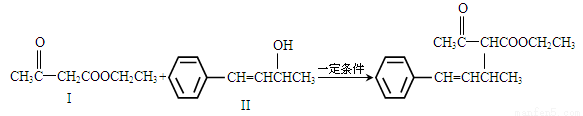
(1)化合物I的分子式为_____,1mol该物质完全燃烧最少需要消耗_____molO2。
(2)化合物II可使____溶液(限写一种)褪色;化合物III(分子式为C10H11C1)可与NaOH水溶液共热生成化合物II,相应的化学方程式为______。
(3)化合物III与NaOH乙醇溶液共热生成化合物IV,IV的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1∶1∶1∶2,IV的结构简式为_______。
(4)由CH3COOCH2CH3可合成化合物I。化合物V是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物VI。V的结构简式为______,VI的结构简式为______。
(5)一定条件下, 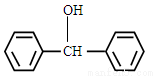 与
与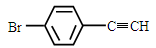 也可以发生类似反应①的反应,有机产物的结构简式为_____。
也可以发生类似反应①的反应,有机产物的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:选择题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表:
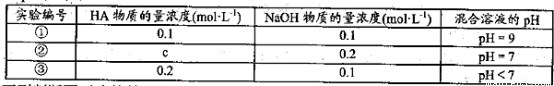
下列判断不正确的是
A.HA的电离方程式为: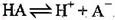
B.不考虑其他组的实验结果,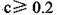
C.③组实验中,混合溶液中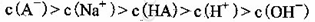
D.①组实验中,混合溶液中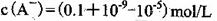
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(8分) CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
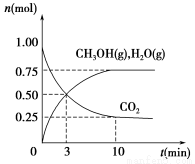
①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大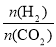 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
如图所示,下列叙述中正确的是
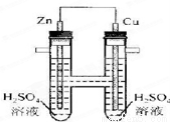
A.正极发生氧化反应 B.电子通过导线由铜流向锌
C.负极有O2逸出 D.铜上有H2逸出
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
当光束通过下列分散系时,能观察到丁达尔效应的是
A.泥水 B.盐酸 C.NaCl 溶液 D.Fe (OH)3 胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com