


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
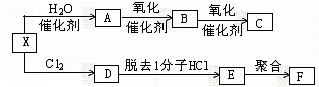
科目:高中化学 来源: 题型:
查看答案和解析>>
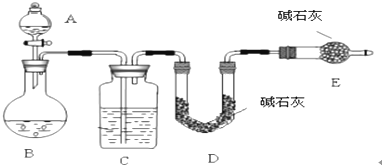
科目:高中化学 来源: 题型:
| A、煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 |
| B、石油分馏得到的汽油、煤油、柴油等都有固定的熔沸点 |
| C、石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
| D、电解冶炼铝的原料是氯化铝 |
查看答案和解析>>
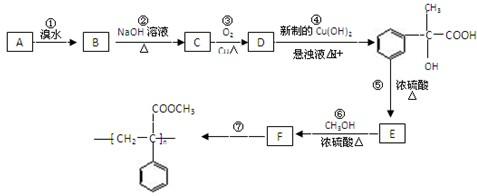
科目:高中化学 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2 | 一定条件 |
| H2 |
| Ni△ |
| 浓硫酸 |
| △ |

查看答案和解析>>
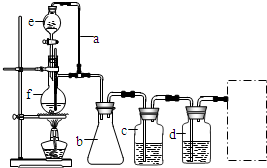
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、根据上述过程,每生成1molKMnO4,共转移6mol电子 | ||||
B、第二步电解时,阳极电极反应式为2MnO
| ||||
C、第二步电解的离子方程式为:2H2O
| ||||
| D、第二步电解时阴极周围pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com