
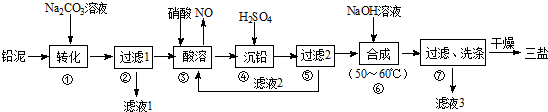
分析 向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液1为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O,然后向溶液中加入硫酸,生成PbSO4沉淀,过滤,滤液2的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,过滤洗涤干燥得到3PbO•PbSO4•H2O,滤液3中含有Na2SO4,结合题目分析解答.
解答 解:向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液1为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成 Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O,然后向溶液中加入硫酸,生成PbSO4沉淀,过滤,滤液2的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,过滤洗涤干燥得到3PbO•PbSO4•H2O,滤液3中含有Na2SO4,
(1)通过以上分析知,碳酸钠和硫酸铅发生难溶物的转化,离子方程式为CO32-+PbSO4=PbCO3+SO42-,故答案为:CO32-+PbSO4=PbCO3+SO42-;
(2)通过以上分析知,滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为Na2SO4•10H2O(或Na2SO4),故答案为:Na2SO4•10H2O(或Na2SO4);
(3)通过以上分析知,该离子反应方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O,滤液2中主要成分是未反应的HNO3,故答案为:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;HNO3;
(4)该反应方程式为4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O,故答案为:4PbSO4+6NaOH=3Na2SO4+3PbO•PbSO4•H2O+2H2O;
(5)该沉淀吸附的离子是硫酸根离子,用盐酸酸化的氯化钡检验,其检验方法为取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全,故答案为:取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析及知识综合应用能力,涉及基本操作、氧化还原反应、离子反应等知识点,明确流程图中发生的反应或操作方法是解本题关键,注意基础知识的积累和灵活运用,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯| A. | ①⑥⑦ | B. | ①③④⑥ | C. | ①④⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com