
下列叙述正确的是( )
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.海水提镁的主要步骤为
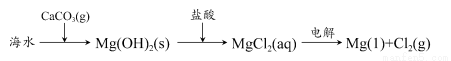
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.向溶液中滴入无色的KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题1化学家眼中的物质世界练习卷(解析版) 题型:选择题
下列与化学概念有关的说法正确的是( )
A.化合反应均为氧化还原反应
B.金属氧化物均为碱性氧化物
C.催化剂能改变可逆反应达到平衡的时间
D.石油是混合物,其分馏产品汽油为纯净物
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
下列关于硫酸工业生产过程的叙述错误的是( )
A.在接触室中使用铁粉作催化剂
B.在接触室中运用热交换技术可充分利用能源
C.把硫铁矿磨成细粉末,可以提高原料的利用率
D.该反应采用450~500°C主要是因为该温度下催化剂活性好
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
A.氮化硅陶瓷是新型无机非金属材料
B.C60属于原子晶体,用于制造纳米材料
C.纤维素乙酸酯属于天然高分子材料
D.单晶硅常用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题12物质结构与性质练习卷(解析版) 题型:选择题
下列各组原子中,彼此的化学性质一定相似的是( )
A.P原子:1s2;Q原子:2s2
B.P原子:M能层上有2个电子;Q原子:N能层上有2个电子
C.P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子
D.P原子:最外层L能层上只有一个空轨道;Q原子:最外层M能层上也只有一个空轨道
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题11有机化学基础练习卷(解析版) 题型:选择题
在同温同压下,某有机物和过量Na反应得到V1L氢气,另一份等量的该有机物和足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )
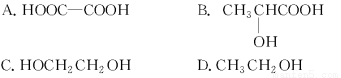
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
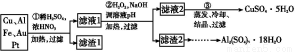
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
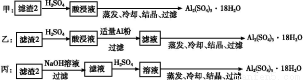
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com