
有下列七种物质:①甲烷、②苯、③聚乙烯、④聚乙炔、⑤2﹣丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液退色,又能使溴水因反应而退色的是()
A. ②③④⑤ B. ③④⑤⑦ C. ④⑤⑥ D. ④⑤⑦
考点: 有机物的结构和性质.
专题: 有机物的化学性质及推断.
分析: 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的有机物,应含有不饱和碳碳键或醛基,以此解答该题.
解答: 解:①甲烷为饱和烃,与酸性高锰酸钾或溴水都不反应,故①错误;
②苯结构特殊、性质稳定,与酸性高锰酸钾或溴水都不反应,故②错误;
③聚乙烯不含不饱和键,不能与酸性高锰酸钾或溴水反应,故③错误;
④聚乙炔含有碳碳双键,可与酸性高锰酸钾或溴水反应,故④正确;
⑤2﹣丁炔含有碳碳三键,可与酸性高锰酸钾或溴水反应,故⑤正确;
⑥环己烷不含不饱和键,不能与酸性高锰酸钾或溴水反应,故⑥错误;
⑦环己烯含有碳碳双键,可与酸性高锰酸钾或溴水反应,故⑦正确.
故选D.
点评: 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意常见有机物官能团的性质,把握与酸性高锰酸钾或溴水反应的物质.


科目:高中化学 来源: 题型:
一定条件下硝酸铵受热分解的未配平化学方程式为NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5∶3 B.5∶4
C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室里过滤一种浑浊溶液,发现滤出的液体仍浑浊,他检查实验装置发现漏斗外壁没有水,滤纸也未出现破损或小漏洞,则造成实验失败的原因可能是下列操作中的( )
|
| A. | 滤纸高出漏斗边缘的部分未剪掉 |
|
| B. | 滤纸与漏斗之间有气泡未被排掉 |
|
| C. | 倾倒液体时液面高于滤纸边缘 |
|
| D. | 过滤时玻璃棒靠在一层滤纸一边 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组化合物中,不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O2和生成的H2O的质量不变的是()
A. C2H2 C6H6 B. C2H6 C3H6 C. C2H4 C3H4 D. C2H4 C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:
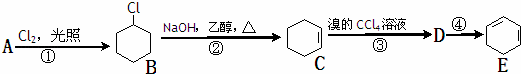
(1)A的结构简式是 ,名称是 ;
(2)填写以下反应的反应类型:① ;② ;③ ;
(3)反应④的反应试剂及反应条件 ;
(4)反应②的化学方程式为 ;B水解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项所描述的两个量中,前者一定大于后者的是()
A. pH=3的盐酸的Cl﹣浓度和pH=3的醋酸溶液的CH3COO﹣浓度
B. pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+)
C. 0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率
D. pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:
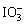 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: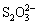 >I-;
>I-;
3I2+6OH-
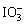 +5I-+3H2O;
+5I-+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
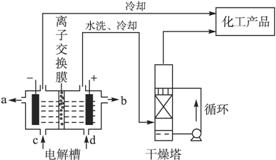
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)如图是离子交换膜法电解饱和食盐水示意图。电解槽阳极产生的气体是____________;NaOH溶液的出口为___________(填字母);精制饱和食盐水的进口为___________(填字 母);干燥塔中应使用的液体是___________。
母);干燥塔中应使用的液体是___________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为____________________________________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为___________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气。现制得氯酸钠213.0 kg,则生成氢气_________m3(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com