
| 1 |
| 2 |
| 1 |
| 4 |
| 3 |
| 4 |
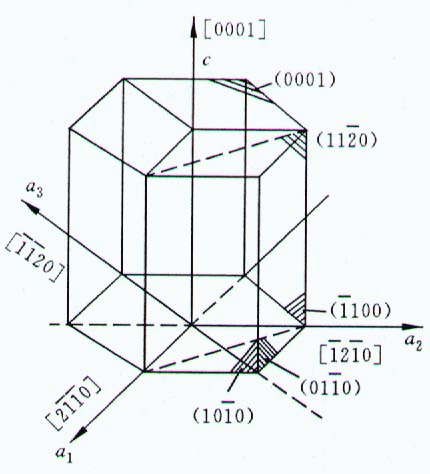 ,当Li在晶胞的顶点,三个M原子在六棱柱的三个不相邻的三角形的中线上并位于1/2的高度上,O原子也在这条中线上但高度分别为1/4和3/4时,可得如图所示的晶胞结构图
,当Li在晶胞的顶点,三个M原子在六棱柱的三个不相邻的三角形的中线上并位于1/2的高度上,O原子也在这条中线上但高度分别为1/4和3/4时,可得如图所示的晶胞结构图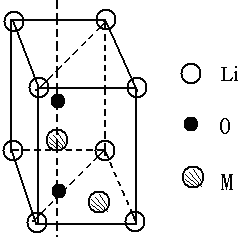 ,故答案为:
,故答案为: ;
;| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 4 |
| 3 |
| 4 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 4 |
| 1 |
| 3 |
| 2 |
| 3 |
| 3 |
| 4 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 4 |
| 1 |
| 3 |
| 2 |
| 3 |
| 3 |
| 4 |


科目:高中化学 来源: 题型:
| ① |
| NaOH |
| ② |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、197>Q1>Q2 |
| B、Q1>2Q3 |
| C、Q1=Q4 |
| D、Q3<Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
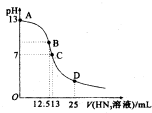 氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:
氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:| T(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO4-)+2c(H2CO3) |
| C、向0.2mol?L-1NaHCO3溶液中加入等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,pH=7的CH3COONa和CH3COOH混合溶液:c(Na+)+c(CH3COO-)═c(H+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
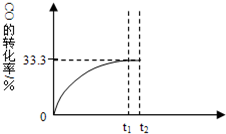 某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28种 | B、32种 |
| C、40种 | D、48种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com