
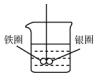
 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液.分析 铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,铁较活泼的金属作负极,银较不活泼的金属作正极,根据正负极上发生的电极反应判断反应现象.
解答 解:(1)银圈是正极,电极上发生的反应式为:Cu2++2e-=Cu;铁较活泼的金属作负极,电极反应式为:Fe-2e-=Fe2+;
故答案为:Cu2++2e-=Cu;Fe-2e-=Fe2+;
(2)依据金属活动顺序可知铁的活泼性强于银,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液后,该装置构成了原电池,铁较活泼的金属作负极,失去电子,发生氧化反应生成铁离子,质量减小;银较不活泼的金属作正极,铜离子在正极得到电子发生还原反应生成铜,在银圈上析出,所以铁圈向上倾斜,银圈向下倾斜,
故答案为:D.
点评 本题考查了电解池工作的原理,明确铁和银的活泼性强弱顺序,原电池工作的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式:KAlSO4•12H2O | ||
| C. | 氨分子的结构式: | D. | NH4H的电子式: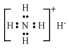 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
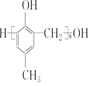 )的合成路线如图:
)的合成路线如图: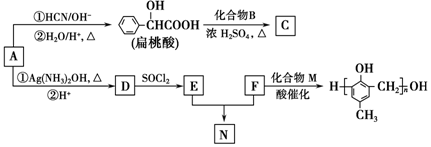
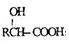
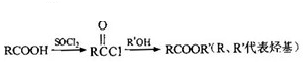
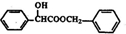 .
. )有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式 (任意一种)..
(任意一种)..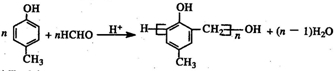
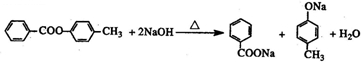 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolB,同时生成3amolA | |
| B. | 容器内压强不再变化 | |
| C. | 单位时间内消耗3amolA,同时生成4amolC | |
| D. | 3v(A)=v(B)=4v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重晶石可作钡餐与白色颜料 | |
| B. | 硫酸是重要的化工原料之一,可用来制造磷肥 | |
| C. | 明矾常用作消毒剂 | |
| D. | 胆矾可用于配置波尔多液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.
氮及其化合物在工农业生产中具有重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应 | |
| C. | 浓硫酸有强氧化性,稀硫酸不具有氧化性 | |
| D. | 实验室中利用浓硫酸的高沸点性来制备HCl等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com