
����Ŀ��I������250mL0.5mol/L��NaOH��Һ��������������ձ�����������������ƽ����ͷ�ιܺ�_______������ʱ���ӹ۲�̶��ߣ�����_______��������ƫ��������ƫС��������������)
����ʵ�����ü��ȹ����Ȼ�狀��������ƵĻ������ȡ��������Ӧ�Ļ�ѧ����ʽ��_______�����Ƶõ������г����������������壬Ϊ�˵õ������İ��������Լ��飬��������װ�û��Լ��У�����Ҫ����������ѡ������Ӧѡ���װ�ñ����ĸ������еĿո�
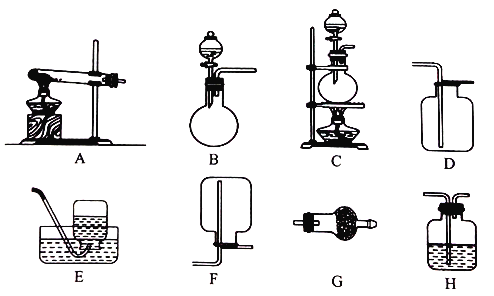
�Լ���a. NaOH��Һ b������ʯ��ˮ c��Ũ���� d������NaHCO3��Һ e����ʯ��
f��Ʒ����Һ g��ʪ��ĺ�ɫʯ����ֽ
��ȡ���� | �������� | ��ȡ����� ����װ�� | �ռ�װ�� | ����װ���� ���õ��Լ� | �����Ƶõ����� �����Լ� |
NH3 | H2O��g�� | _______ | F | e | _______ |
���𰸡� 25Oml����ƿ ƫ�� Ca(OH)2+2NH4Cl![]() 2NH3��+CaCl2+2H2O A g
2NH3��+CaCl2+2H2O A g
��������(1)��������250mL0.5mol/L��NaOH��Һ��Һ�IJ����֪�����ƹ�������Ҫ������Ϊ�ձ�����������������ƽ����ͷ�ιܺ�250mL����ƿ�ȣ�����ʱ���ӹ۲�̶��ߣ�Һ���ڿ̶����·�����Һ���ƫС��������ҺŨ��ƫ��
(2)��ȡ�����Ǽ��ȹ����Ȼ�狀��������ƵĻ���������Ӧ�Ļ�ѧ����ʽΪCa(OH)2+2NH4Cl![]() 2NH3��+CaCl2+2H2O�����������ȷ�Ӧ��������ѡ����Թܼ���װ��A�������Ƶ����������Լ������ð����Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ����ɫ����Ϊg��
2NH3��+CaCl2+2H2O�����������ȷ�Ӧ��������ѡ����Թܼ���װ��A�������Ƶ����������Լ������ð����Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ����ɫ����Ϊg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5-��������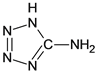 ���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�
���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�
��1����̬Gaԭ�ӵĵ����Ų�ʽ�ɱ�ʾΪ__________��
��2��5-��������������Ԫ�صĵ縺���ɴ�С��˳��Ϊ__________����1mol 5-���������к��еĦҼ�����ĿΪ__________��
��3���������ƣ�NaN3���Ǵ�ͳ����������ȫ������ʹ�õ����巢������
�ٵ������ƣ�NaN3���к��е���������ӣ�N3-�������ݵȵ�����ԭ��N3-�Ŀռ乹��Ϊ__________��
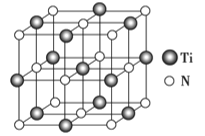
�������Ȼ��ѡ�̼���ơ�����������ԭ�ϣ���������̼���� �ѻ������ṹ����̼ԭ��ȡ�������Ѿ������ṹ��ͼʾ������ĵ�ԭ�ӣ�����̼�����ѻ�����Ļ�ѧʽΪ__________��
��[Ti(OH)2(H2O)4]2+�еĻ�ѧ����__________��
a���Ҽ� b���м� c�����Ӽ� d����λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��صķ����ǻ�ѧ�������һ���ش��ס�
��1��һ������ȼ�ϵ�أ����Զ�ײ���Ϊ�����缫����ϡ�����У�Ȼ��ֱ�������ͨ����������������õ��ܡ�ͨ�������ĵ缫��ӦʽΪ________________________���ŵ�һ��ʱ�����������Һ��pH________������ߡ������͡����䡱����
��2�����ӹ�ҵ�ϳ�����FeCl3��Һ��ʴͭ������ӡˢ��·���䷴Ӧ�Ļ�ѧ����ʽΪ________________________����Ѹ÷�Ӧ��Ƴ�һ��ԭ��أ��ڷ��������ԭ���װ��ͼ��Ҫ�����缫���Ϻ͵������Һ����_______

��3�������£�����ȥ��������Ĥ����Ƭ��ͭƬ����ŨHNO3�����ԭ���װ����ͼ����ʾ�����ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ����ʾ����Ӧ�������к���ɫ���������
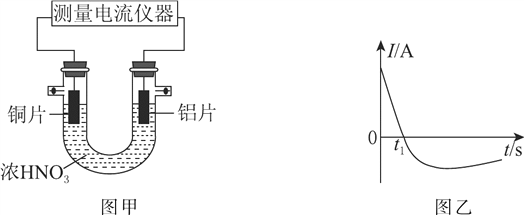
t1sǰ��ԭ��صĸ�������Ƭ�������ĵ缫��ӦʽΪ____________����Һ�е�H����________����������������ƶ���t1s�����·�е��������������ı䣬��ԭ����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��2004�����������ıʼDZ��������õļ״�ȼ�ϵ�صĽṹʾ��ͼ���״��ڴ��������� �ṩ����(H+)�͵��ӡ����Ӿ����·�����Ӿ��ڵ�·������һ����������Ӧ������ܷ�ӦʽΪ��2CH3OH��3O2��2CO2��4H2O������˵���в���ȷ����
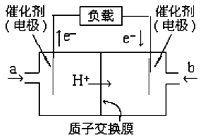
A. ��ߵĵ缫Ϊ��صĸ�����a��ͨ����Ǽ״�
B. ÿ����3.2������ת�Ƶĵ�����Ϊ0.4mol
C. ��ظ����ķ�ӦʽΪ��CH3OH + H2O �� 6e��==CO2+ 6H+
D. ��ص�������ӦʽΪ��O2+2H2O+4e��==4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ�ȵ���������ȷ���ǣ� ��
���±����ݿ��Լ���� 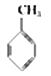 ��g��+3H2��g����
��g��+3H2��g���� 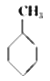 ��g���ķ�Ӧ�ȣ�
��g���ķ�Ӧ�ȣ�
���ۼ� | C��C | C�TC | C��H | H��H |
����/��kJmol��1�� | 348 | 610 | 413 | 436 |
����֪2H2��g��+O2��g���T2H2O��g����H=��483.6kJmol��1�� ��������ȼ����Ϊ��H=��241.8kJmol��1
���ɵ���Aת��Ϊ����B��һ�����ȹ��̣��ɴ˿�֪����B�ȵ���A�ȶ�
��X��g��+Y��g���TZ��g��+W��s����H��0�����º��������´ﵽƽ������X��������Ӧ�ġ�H����
���ɸ�˹���ɣ���֪����ͬ�����£����ʯ��ʯīȼ������1molCO2����ʱ���ų���������ȣ�
��25�棬101kPaʱ��1mol̼��ȫȼ������CO2���ų�������Ϊ̼��ȼ���ȣ�
A. �٢ڢۢ� B. �ۢܢ� C. �ܢ� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л��ﲢ�ṩ��Ҫ�����Լ���CH3CH2Cl��CH3CH2OH��ŨH2SO4��NaOHˮ��Һ��NaOH����Һ���밴����Ҫ����д�йط�Ӧ�Ļ�ѧ����ʽ��
�ٷ�Ӧ����ͬ����Ӧ�¶Ȳ�ͬ�õ��IJ��ﲻͬ�ķ�Ӧ��
____________________________________��____________________________________
�ڷ�Ӧ����ͬ����Ӧ�ܼ���ͬ���õ��IJ��ﲻͬ�ķ�Ӧ��
____________________________________�� ____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH2CH2Br�Ʊ�CH3CH(OH)CH2OH�����Σ��������ң������ķ�Ӧ���ͺͷ�Ӧ��������ȷ���ǣ� ��
ѡ�� | ��Ӧ���� | ��Ӧ���� |
A | �ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
B | ��ȥ��Ӧ���ӳɷ�Ӧ��ȡ����Ӧ | NaOH����Һ/���ȡ����¡�NaOHˮ��Һ/���� |
C | ������Ӧ��ȡ����Ӧ����ȥ��Ӧ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
D | ��ȥ��Ӧ���ӳɷ�Ӧ��ˮ�ⷴӦ | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ڣ�100 ���ĵ����ºϳ�һ����X���˷��ӵĽṹ��ͼ��ʾ(ͼ�е����߱�ʾ��ѧ��)������˵����ȷ����

A��X����ʹ������Ȼ�̼��Һ��ɫ������ʹ����KMnO4��Һ��ɫ
B��X��һ�ֳ��������ȶ����ڵ�Һ̬��
C��X���������ƣ���������ȡ����Ӧ
D�����ȼ�յ�������X�ͼ��飬X���������϶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д��ڽ϶��H+��SO42-��Cl-���ӣ������Դ������ڵ���
A. OH- B. CO32- C. NH4+ D. Ba2+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com