
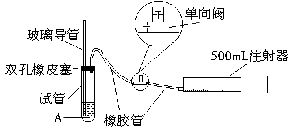
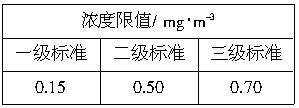
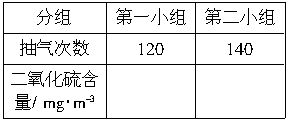
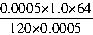 =0.53(mg?m-3)
=0.53(mg?m-3)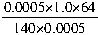 =0.46(mg?m-3)
=0.46(mg?m-3)

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
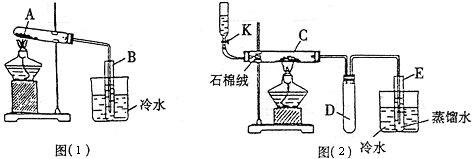
| ||
| ||
| △ |
| △ |
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
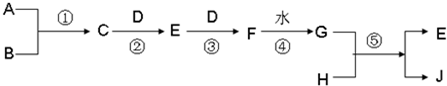
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
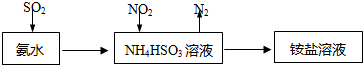
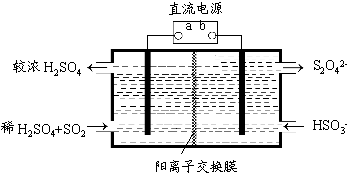
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市普陀区高三下学期二模化学试卷(解析版) 题型:填空题
研究NO2 、SO2 、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高。增大该反应平衡常数的措施有 。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是 。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2) = 7v(N2)
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比 m/n(填“>”、“=”或“<”)。
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:
v(NH3) = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com