
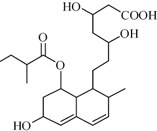
 M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )
M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )| A. | M不能与FeCl3溶液发生显色反应 | |
| B. | 0.1mol M足量的Na反应可产生4.48LH2 | |
| C. | M能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与2molNaOH反应 |
分析 由结构简式可知,分子中含-OH、-COOH、-COOC-、碳碳双键,结合醇、羧酸、酯、烯烃的性质来解答.
解答 解:A.不含酚-OH,则不能与FeCl3溶液发生显色反应,故A正确;
B.分子中含有3个羟基,1个羧基,0.1mol M足量的Na反应可产生0.2molH2,但条件未知,不能确定体积大小,故B错误;
C.含碳碳双键发生加成反应、氧化反应,含-OH可发生取代、消去反应、氧化反应,故C正确;
D.-COOH、-COOC-均与NaOH溶液反应,则1mol该物质最多可与2molNaOH反应,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、羧酸、酯、烯烃性质的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
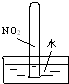 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 实验①试管最终会充满水 | |
| B. | 实验②试管中溶液变为血红色 | |
| C. | 实验③试管中出现砖红色沉淀 | |
| D. | 实验④CuSO4溶液中会形成一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的燃煤中加适量石灰石,有利于环境保护 | |
| B. | 硅胶可做装食品的干燥剂 | |
| C. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| D. | 利用农作物秸秆制取乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+ )>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 0.01mol•L-1 的NaHCO3 溶液中存在如下平衡:HCO3-?H++CO3 2-,加水稀释溶液中的HCO3-、H+、CO3 2-浓度减少 | |
| C. | 浓度均为0.1mol•L-1 的CH3COOH、CH3COOK混合溶液中,2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) | |
| D. | 若Ka(HA)=3.6×10-4,Ka(HB)=1.75×10-5,则等物质的量浓度的NaA、KB溶液相比:c(Na+ )-c(A-)=c(K+ )-c(B-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com