
| A. | 用氢氟酸对玻璃进行刻蚀可制成赏心悦目的雕花玻璃 | |
| B. | Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3•10H2O | |
| C. | 氯水和干燥的氯气均能使鲜花褪色 | |
| D. | 合金的硬度可以大于它的纯金属部分,合金的熔点也可以低于它的成分金属 |
分析 A.氢氟酸能与玻璃中二氧化硅反应;
B.Na2CO3粉末可与水以不同的物质的量之比形成多种晶体;
C.氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;
D.合金的硬度高、熔点低.
解答 解:A.氢氟酸能与玻璃中二氧化硅反应,能够腐蚀玻璃,可以用于雕花玻璃,故A正确;
B.Na2CO3粉末可与水以不同的物质的量之比形成多种晶体,故B错误;
C.氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,鲜花中含有水,所以氯水和干燥的氯气均能使鲜花褪色,故C正确;
D.合金的硬度高、熔点低于组分金属的熔点,故D正确;
故选:B.
点评 本题考查生活中常见的物品的化学性质,熟悉相关物质的性质和用途是解题关键,注意氯气不具有漂白性,注意合金的性质.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3 | B. | Fe→FeCl2 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 盐酸 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
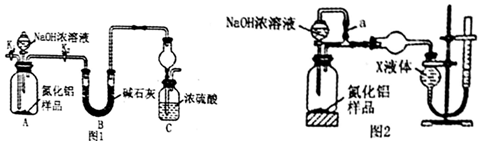
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

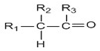
 →
→
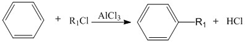
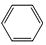 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$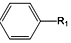 +HCl
+HCl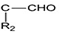 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: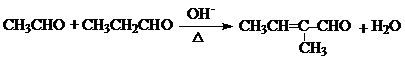 .
.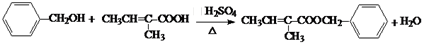 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com