
| A. | 活性炭与新制氯水的漂白原理相同 | |
| B. | 过氧化钠常用于羽绒制品的漂白 | |
| C. | 漂白粉是由Ca(ClO)2组成的纯净物 | |
| D. | 将漂白剂SO2和NaClO混合使用可增加漂白效果 |
分析 A.活性炭利用的是吸附性,而氯水漂白利用的是强氧化性;
B.根据过氧化钠具有强氧化性和漂白性分析;
C.漂白粉是次氯酸钙和氯化钙组成的混合物;
D.次氯酸钠能够氧化二氧化硫,降低了漂白效果.
解答 解:A.活性炭与新制氯水的漂白原理不同,活性炭利用的吸附性,而新制氯水利用的是次氯酸的强氧化性,故A错误;
B.过氧化钠具有强氧化性和漂白性,可用于羽绒制品的漂白,故B正确;
C.漂白粉是由Ca(ClO)2、CaCl2组成的混合物,故C错误;
D.SO2和NaClO之间发生氧化还原反应,从而降低了漂白效果,故D错误;
故选B.
点评 本题考查了漂白原理及其应用,题目难度中等,明确常见物质漂白原理及区别为解答关键,注意掌握漂白粉、漂粉精、漂白液等组成,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
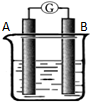 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉加入到Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe | |
| B. | 钠块投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| C. | Cl2通入到NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 用NaOH溶液吸收少量CO2:OH-+CO2═HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )
一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )| A. | 温度T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{{T}^{2}}}$ | |
| B. | 温度T℃时,混合气体的密度不变即达到平衡状态 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b改变的条件是温度,则该正反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
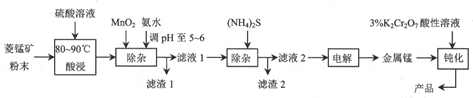
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②④⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用.
为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用. ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com