
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
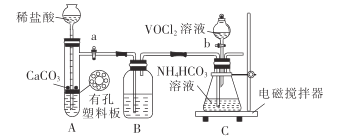
①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
【答案】2V2O5+N2H4﹒2HCl+6HCl=4VOCl2+N2↑+6H2O 氯气有毒,污染空气 打开活塞a数分钟后,再打开活塞b HCl与NH4HCO3反应 Cl- 除去过量的KMnO4 2.88%
【解析】
V2O5与盐酸、N2H4﹒2HCl混合发生反应:2V2O5+N2H4﹒2HCl+6HCl=4VOCl2+N2↑+6H2O,得到VOCl2溶液,加碳酸氢铵溶液后得到氧钒(IV)碱式碳酸铵晶体。(1)根据原子守恒及氧化还原反应原理分析解答;(2)根据题给信息中+4价V易被氧化的性质分析解答;(3)根据原子守恒及晶体的组成分析解答;(4)根据滴定原理及氧化还原反应原理分析解答。
(1)根据原子守恒分析生成的一种无色无污染的气体为N2,该反应的化学方程式为2V2O5+N2H4﹒2HCl+6HCl=4VOCl2+N2↑+6H2O;根据氧化还原反应原理分析,V被还原,则浓盐酸的中Cl被氧化生成氯气,氯气有毒,污染空气,故答案为:2V2O5+N2H4﹒2HCl+6HCl=4VOCl2+N2↑+6H2O;氯气有毒,污染空气;
(2)①已知VO2+能被O2氧化,故装置中不能有空气,所以反应前先通入CO2数分钟排除装置中的空气,避免产物被氧化,所以实验操作时先打开活塞a数分钟后,再打开活塞b,故答案为:打开活塞a数分钟后,再打开活塞b;
②A中制得的二氧化碳混有氯化氢气体,B装置中的试剂应是除去二氧化碳气体中HCl气体的饱和NaHCO3溶液,若无装置B,则HCl与NH4HCO3反应,故答案为:HCl与NH4HCO3反应;
(3)根据原子守恒分析,及晶体的组成分析,NH4 HCO3溶液洗涤除去阴离子主要是Cl-,故答案为:Cl-;
(4)①根据分析,KMnO4溶液的作用是氧化V,NaNO2溶液的作用是除去过量的KMnO4,故答案为:除去过量的KMnO4;
②根据V元素的质量守恒,根据滴定反应VO2+ + Fe2++2H+=VO2++ Fe3++H2O,则n(V)=n((NH4)2Fe(SO4)2)= 0.08 mol·L-1×0.03L=0.0024mol,则粗产品中钒的含量为:![]() ,故答案为:2.88%。
,故答案为:2.88%。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述正确的是( )

A.SO32-水解常数Kh的数量级为10-8
B.若滴定到第一反应终点,可用酚酞作指示剂
C.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液
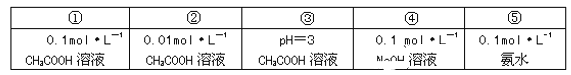
回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④。
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是_________________________________(填字母)。
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体_______(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.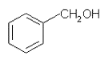 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B.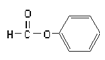 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C.![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如下图所示。下列说法不正确的是
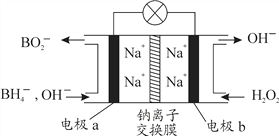
A. 每消耗3mol H2O2,转移6mol e-
B. 电池工作时Na+从b极区移向a极区
C. b极上的电极反应式为:H2O2 + 2e-= 2OH-
D. a极上的电极反应式为:BH4-+ 8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用有机物苯实现电化学储氢的原理如下图所示。下列说法中不正确的是( )

A.Ag-Pt极的电极反应式为:C6H6+6H++6e-== C6H12
B.总反应式为2C6H6+6H2O→2C6H12+3O2↑
C.通电后H+离子由左池向右池迁移
D.当电路中通过1mol电子的电量时,会有0.25molO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.pH之和为14的H2C2O4与NaOH溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
C.0.1mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
D.将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:
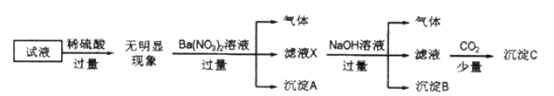
下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D. 无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com