
 N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��
N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע�� ��
��| t/s | 0 | 500 | 1000 |
| c��N2O5��/mol•L-1 | 5.00 | 3.52 | 2.48 |
���� ��1������1����ԭ�ӱ�-NO2ȡ��������������
��2���ٺ��º����£�ͨ�뵪������Ӧ��������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
����ͼ��֪��500s��N2O5��Ũ�ȱ仯��Ϊ5mol/L-3.52mol/L=1.48mol/L������v=$\frac{��c}{��t}$����N2O5�ķֽ����ʣ�
���ɱ������ݿ�֪����T2�¶��£���Ӧ1000sʱ���NO2��Ũ��Ϊ4.98mol•L-1�����ʱN2O5��Ũ��Ϊ5mol/L-$\frac{1}{2}$��4.98mol•L-1=2.51mol/L��������T1�¶��£���Ӧ1000sʱ���NO2��Ũ�ȣ�˵�����¶��·�Ӧ������г̶�С��
��3����N2O4��ȡN2O5��Ҫʧȥ���ӣ�����N2O5�����������ɣ�
��� �⣺��1��N2O5�뱽����������Ӧ������1����ԭ�ӱ�-NO2ȡ�������������������������Ľṹ��ʽ�� ��
��
�ʴ�Ϊ�� ��
��
��2���ٺ��º����£�ͨ�뵪������Ӧ��������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���N2O5��ת���ʲ��䣬
�ʴ�Ϊ�����䣻
����ͼ��֪��500s��N2O5��Ũ�ȱ仯��Ϊ5mol/L-3.52mol/L=1.48mol/L����N2O5�ķֽ�����Ϊ$\frac{1.48mol/L}{500s}$=0.00296 mol•L-1•s-1��
�ʴ�Ϊ��0.00296 mol•L-1•s-1��
���ɱ������ݿ�֪����T2�¶��£���Ӧ1000sʱ���NO2��Ũ��Ϊ4.98mol•L-1�����ʱN2O5��Ũ��Ϊ5mol/L-$\frac{1}{2}$��4.98mol•L-1=2.51mol/L��������T1�¶��£���Ӧ1000sʱ���NO2��Ũ�ȣ�˵�����¶��·�Ӧ������г̶�С�����¶�T2��T1��
�ʴ�Ϊ������
��3���ӵ��ԭ��������N2O4�Ʊ�N2O5Ϊ������Ӧ����N2O5Ӧ�����������ɣ���ӦʽΪN2O4+2HNO3-2e-=2N2O5+2H+��
�ʴ�Ϊ��������N2O4+2HNO3-2e-=2N2O5+2H+��
���� ������N2O5Ϊ�����ۺϿ���ѧ����֪ʶӦ���������漰��ѧ��Ӧ���ʼ��㡢��ѧƽ���ƶ������ԭ����֪ʶ�㣬��Ŀ�Ѷ��еȣ�ע�����յ��ԭ�������ã�Ϊ��Ƶ���㣮


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba2+��K+��OH-��NO3- | B�� | NH4+��Mg2+��SO42-��Cl- | ||
| C�� | Al3+��Cu2+��SO42-��Cl- | D�� | Na+��Ca2+��Cl-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�������Һ | B�� | ��������ϡ��Һ | C�� | ����ͭ��Һ | D�� | �Ȼ�þ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
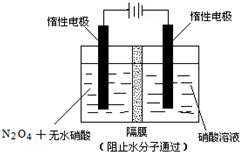
 ���ð�ˮ���������еĶ�����������ط�Ӧ����Ҫ�Ȼ�ѧ����ʽ���£�
���ð�ˮ���������еĶ�����������ط�Ӧ����Ҫ�Ȼ�ѧ����ʽ���£�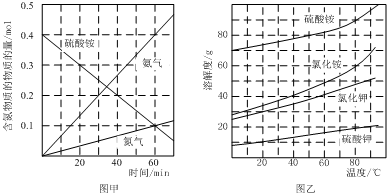
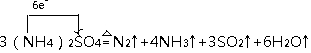 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
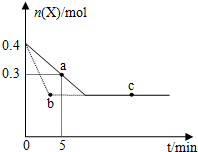
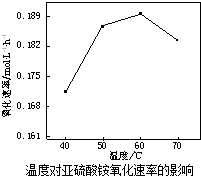
| A�� | ���߱�ʾʹ�ô��������� | |
| B�� | b��c���������Ӧ����Ӧ�����´ﵽ������� | |
| C�� | ��Ӧ���е�a��ʱ�ų����������ڷ�Ӧ���е�b��ʱ�ų������� | |
| D�� | ��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��Y��=0.01mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��4mL0.1mol/L��K2Cr2O7��Һ�еμ�����1mol/LNaOH��Һ����Һ��ɫ�ӳ�ɫ��ɻ�ɫ | |
| B�� | ��Na2S2O3��Һ�е�������ϡ���ᣬ��Һ����Ϊ��ɫ | |
| C�� | ��Ѫ��ɫ��Fe��SCN��3��Һ�м�������KI���壬��Һ��ɫ��dz | |
| D�� | ��50mL��Ͳ��ȡ30mL����ɫ��NO2���岢��סע��ף���������ѹ������ѹ����Ͳ�е����壨�˹����в������¶ȱ仯����������ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | abc | B�� | bcd | C�� | abd | D�� | abcd |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3s2��ʾ3s�ܼ���������� | |
| B�� | �������������ԭ�ӽ�����̬ԭ�� | |
| C�� | ͬһԭ���У�1s��2s��3s���ӵ�������С | |
| D�� | ͬһԭ���У�3d��4d��5d�ܼ��Ĺ������������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com