
| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
分析 A.设二氧化碳、CO物质的量分别为xmol、ymol,根据二者总质量、总物质的量列方程计算各自物质的量;
B.二氧化碳为酸性气体,能够与氢氧化钠反应,一氧化碳不溶于水,与氢氧化钠不反应;
C.依据M=$\frac{m}{n}$计算气体平均摩尔质量,摩尔质量以g/mol为单位数值上等于相对分子质量;
D.依据V=nVm、ρ=$\frac{m}{V}$计算气体的密度.
解答 解:A.设二氧化碳、CO物质的量分别为xmol、ymol,根据二者总质量、总物质的量可得:
x+y=0.3
44x+28y=10.8
解得x=y=0.15,所以二者物质的量之比为1:1,故A正确;
B.二氧化碳为酸性气体,能够与氢氧化钠反应,一氧化碳不溶于水,与氢氧化钠不反应,所以混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳,故B正确;
C.混合气体的平均摩尔质量为M=$\frac{10.8g}{0.3mol}$=36g/mol,所以其混合气体的平均相对分子质量为36,故C错误;
D.标准状况下,混合气体的体积为0.3mol×22.4L/mol=6.72L,则其密度为$\frac{10.8g}{6.72L}$=1.61g/L,故D错误;
故选:CD.
点评 本题考查了物质的量有关计算,明确以物质的量为核心的计算公式是解题关键,注意摩尔质量与相对分子质量的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 只测定它的C、H比 | |
| B. | 只需证明它完全燃烧后产物只有H2O和CO2 | |
| C. | 只测定其燃烧产物中H2O与CO2的物质的量的比值 | |
| D. | 测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 16gO2和O3的混合气体中所含的原子数为NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-离子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
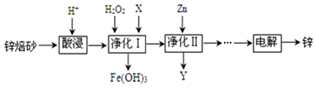
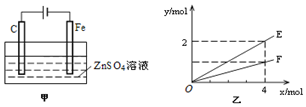
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓度 (mol/L) | C O初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| 1 | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| 2 | 124 | |||
| 3 | 350 | 124 |
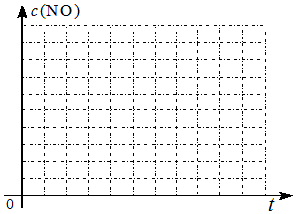
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com