
| A. | 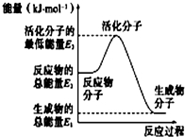 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
分析 A.焓变为生成物、反应物总能量之差;
B.燃烧热是指1mol燃料完全燃烧生成稳定的化合物放出的热量;
C.合成氨的反应为可逆反应,热化学反应方程式中为完全转化时的能量变化,且物质的量越多,压强越大,利用合成氨;
D.由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),以此计算焓变.
解答 解:A.由图可知,反应②中的生成物、反应物的总能量,则△H2=E1-E2,故A错误;
B.燃烧热是指1mol燃料完全燃烧生成稳定的化合物,H2的燃烧热为1mol氢气完全燃烧生成液体水时放出的热量,△H=$\frac{1}{2}$×②=-285.8kJ•mol-1才是H2的燃烧热,故B错误;
C.根据可逆反应的特征在一恒容密闭容器中通入1molN2和3molH2,不可能生成2mol的氨气,所以放出的热量小于92.4,若通入2 mol N2和6 mol H2反应容器的压强增大,反应进行的程度大,所以放出的热量Q2>2Q1,则184.8>Q2>2Q1,故C正确;
D.由①N2(g)+O2(g)=2NO(g)△H=+180kJ/mol、②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol、③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol及盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906kJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握图象中能量变化、燃烧热的概念、可逆反应中能量变化及盖斯定律应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
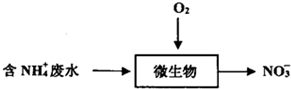
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应. RCHO+R′CHO
RCHO+R′CHO .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
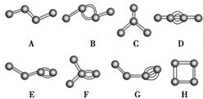 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
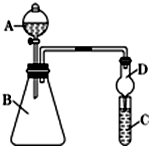 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
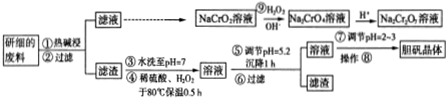
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com