
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,pH增大 |
分析 A.水解平衡常数只与温度有关;
B.加入NaOH固体,c(OH-)增大,水解平衡逆向移动;
C.水解反应为吸热反应;
D.通入CO2,发生通入CO2+CO32-+H2O?2HCO3-(或CO2+OH-=HCO3-),溶液的碱性减弱.
解答 解:A.水解平衡常数只与温度有关,则稀释溶液,水解平衡常数不变,故A错误;
B.加入NaOH固体,c(OH-)增大,水解平衡逆向移动,可知$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小,故B正确;
C.水解反应为吸热反应,则升高温度,平衡常数增大,故C错误;
D.通入CO2,发生通入CO2+CO32-+H2O?2HCO3-(或CO2+OH-=HCO3-),溶液的碱性减弱,则溶液pH减小,故D错误;
故选B.
点评 本题考查水解平衡的移动,为高频考点,把握温度、浓度对水解平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意水解平衡常数只与温度有关,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷和异丁烷的一氯取代物都只有两种,它们的沸点也相同 | |
| B. | 乙烯分子与苯分子都能与H2发生加成反应,说明二者均含碳碳双键 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 乙醛加入Cu(OH)2粉末并加热可看到红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
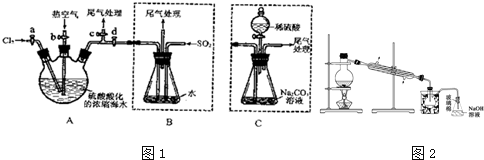
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 | |
| C. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 | |
| D. | 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com