
下表是NaCl和CsCl的熔沸点的比较。
|
|
NaCl |
CsCl |
|
熔点 |
801 ℃ |
645 ℃ |
|
沸点 |
1 413 ℃ |
1 290 ℃ |
(1)同为离子晶体,为什么NaCl的熔沸点比CsCl的高?请从影响离子键强弱的因素入手进行分析。
(2)实验证明,干燥的NaCl晶体不导电,熔融的NaCl或NaCl溶液却可以导电,你能说明其中的原因吗?
(1)离子键是存在于阴、阳离子之间的一种静电作用。其强弱与阴、阳离子的半径和离子电荷数有关。一般来说,离子半径越小,离子电荷数越高,离子键就越强,晶体熔沸点就越高。从库仑定律可直接看出这一关系(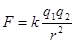 )。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
)。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
(2)电流是由带电粒子的定向移动形成的。NaCl晶体中虽有带电的Na+、Cl-存在,但由于较强的离子键将阴、阳离子紧密结合而不能自由移动,故固态不能导电,而当晶体受热熔化时,由于温度升高,离子运动加快,克服了阴、阳离子间的作用力,产生了自由移动的离子,所以,熔融NaCl能导电。当NaCl晶体溶于水时,受水分子的影响,离子间作用力减弱,电离成能自由移动的水合离子,所以,NaCl水溶液也能导电。
【解析】
试题分析:(1)离子键是存在于阴、阳离子之间的一种静电作用。其强弱与阴、阳离子的半径和离子电荷数有关。一般来说,离子半径越小,离子电荷数越高,离子键就越强,晶体熔沸点就越高。从库仑定律可直接看出这一关系( )。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
)。对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs+),所以F(NaCl)>F(CsCl),故熔沸点为:NaCl>CsCl。
(2)电流是由带电粒子的定向移动形成的。NaCl晶体中虽有带电的Na+、Cl-存在,但由于较强的离子键将阴、阳离子紧密结合而不能自由移动,故固态不能导电,而当晶体受热熔化时,由于温度升高,离子运动加快,克服了阴、阳离子间的作用力,产生了自由移动的离子,所以,熔融NaCl能导电。当NaCl晶体溶于水时,受水分子的影响,离子间作用力减弱,电离成能自由移动的水合离子,所以,NaCl水溶液也能导电。
考点:考查影响离子晶体熔沸点高低因素的判断以及物质导电的原因
点评:该题是中等难度的试题,试题基础性强,侧重考查学生分析问题、解决问题的能力。有利于培养学生的创新思维能力和严谨的逻辑思维能力,也有利于培养学生的语言表达、组织能力和规范答题能力。


科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com