
【题目】下列分子中,所有原子都满足最外层为8电子结构的是( )
A. BF3 B. NCl3 C. PCl5 D. CHCl3
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
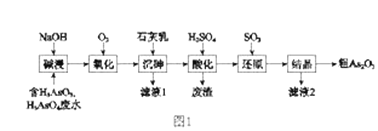
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
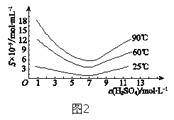
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为________________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线: _____________。
的合成路线: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 1 mol重水(D2O)与1 mol水(H2O)中,中子数比为5∶4
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制Fe3O4纳米颗粒的总反应为3Fe2+ + 2S2O32- + O2 + xOH- = Fe3O4 + S4O62- + 2H2O。下列说法正确的是( )
A. O2、S2O32-都是氧化剂
B. x=2
C. 将纳米Fe3O4颗粒分散在水中会产生丁达尔效应
D. 氧化产物只有S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。
(1)产物的物质的量为:n(H2O)=____mol,n(CO)=____mol,n(CO2)=____mol。
(2)该有机物的分子式为________。
(3)等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物所含官能团名称为__________,该有机物的结构简式为_________。
(4)写出该有机物与乙醇发生酯化反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 18 g H2O、D2O组成的物质中含有的质子数为10NA
B. 1 mol白磷分子(P4)中含有的P—P键的数目为6NA
C. 0.1molNaCl中含有0.1NA个NaCl分子
D. 在反应2Na2O2+CO2===2Na2CO3+O2↑中,每生成32g O2转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为____kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com