
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8O并能与金属钠反应放出氢气的有机化合物有3种 | |
| B. | 甲苯在一定条件下与H2完全加成,加成后的产物其一氯代物的同分异构体有5种 | |
| C. | 甲醇,乙二醇互为同系物 | |
| D. | 1mol某烷烃完全燃烧消耗11mol O2,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一个物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 1mol12C与0.012kg12C所含碳原子数相同 | |
| D. | 1molO2约含6.02×1023个氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2g O 2所含的原子数为0.2NA | |
| B. | 标准状况下,18g H2 O所含的氧原子数目为NA | |
| C. | 常温常压下,92g NO2和N2O 4的混合气体中含有的原子总数为6 NA | |
| D. | 标准状况下,22.4LCH4与22.4L N2所含原子数均为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
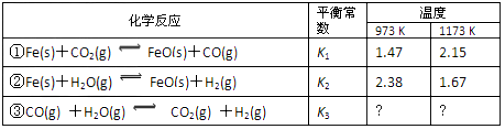
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 亚硫酸盐作为食品添加剂,作用是防腐保鲜 | |
| B. | 反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应④的反应类型是加聚 | B. | 物质A含有两种官能团 | ||
| C. | 物质B催化氧化后可以得到乙醛 | D. | 1mol物质D最多可以消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
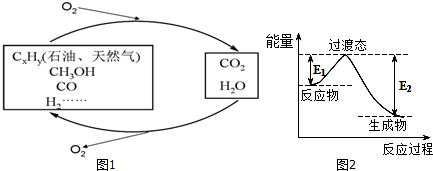
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com