
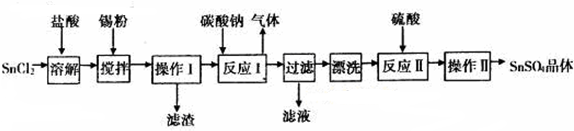
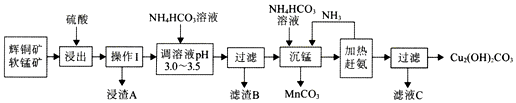
分析 因酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化,SnCl2溶解后加入Sn,可防止Sn2+被氧化,且还原Sn4+,得到溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体.
(1)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(2)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(3)操作Ⅰ为过滤,需要漏斗、烧杯、玻璃棒等仪器;
(4)用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,以此计算.
解答 解:(1)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2+H2O?Sn(OH)Cl+HCl;
(2)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(3)操作Ⅰ为过滤,需要漏斗、烧杯、玻璃棒等仪器,故答案为:漏斗、烧杯、玻璃棒;
(4)具有强氧化性,应放在酸式滴定管中,避免腐蚀橡胶管,
用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7计算.
119g $\frac{1}{3}$mol
2.0g×x 0.100mol/L×0.04L
故 $\frac{119}{2.0x}$=$\frac{\frac{1}{3}}{0.100×0.04}$,解得x=71.4%,
故答案为:酸式;71.4%.
点评 本题以SnSO4的制备为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力,为高考常见题型,题目还涉及滴定应用及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 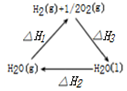 图表示:△H1=△H2+△H3 | |
| B. | 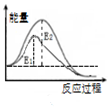 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 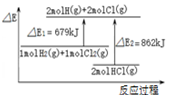 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 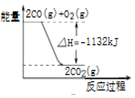 图表示:CO的燃烧热为1132KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
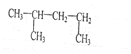
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
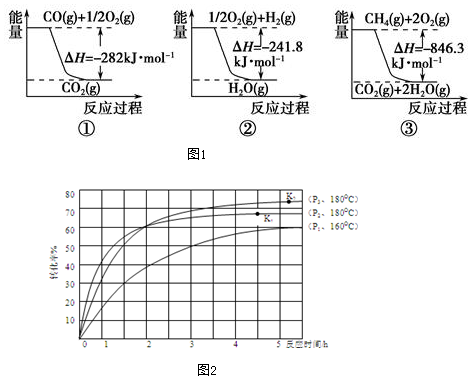
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或
 ).
).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com