
| A. | NaCl | B. | Cl2 | C. | Na和Mg | D. | NaOH和H2 |
分析 A、海水蒸发即可得到氯化钠;
B、可从海水中获得氯化钠,配制成饱和食盐水,然后电解,即得氯气;
C、海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁即得钠和镁;
D、可从海水中获得氯化钠,配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气.
解答 解:A、海水蒸发水后可以得到氯化钠,不需要化学变化,属于物理变化,故A正确;
B、电解饱和食盐水能得到氯气,属于化学变化,故B错误;
C、钠与镁在海水中均是以离子形式存在,需要电解熔融状态的氯化钠和氯化镁即得钠和镁,属于化学变化,故C错误;
D、电解饱和食盐水可以得到NaOH和氢气,属于化学变化,故D错误;
故选A.
点评 本题考查了海水的成分,以及提炼溴、碘、钠、镁、氢气等物质的原理,涉及的知识较多,掌握制备原理是解题的关键.


科目:高中化学 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Cl-、NO3-、Na+、CO32- | |
| B. | c(H+)=1.0×10-13mol•L的溶液中:MnO4-、K+、SO42-、AlO2- | |
| C. | c(AlO2-)=1.0mol•L的溶液中:SO42-、K+、Cl-、HCO3- | |
| D. | pH=7的溶液中:NO2-、I-、Na+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

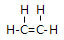 ;由元素④和元素②形成的化合物的电子式为
;由元素④和元素②形成的化合物的电子式为 ;元素⑦的原子结构示意图为
;元素⑦的原子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硫酸和浓硝酸分别长期露置在空气中,浓度均会降低 | |
| B. | 在常温下,浓硫酸和浓硝酸均能与铜剧烈反应 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铁反应,所以常温下二者都不能用铁制容器盛装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去二氧化碳气体中的二氧化硫 | |
| B. | 可用干燥的淀粉碘化钾试纸检验氯气 | |
| C. | 某溶液焰色反应的火焰呈黄色,说明该溶液中肯定含钠离子不确定是否含钾离子 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (若有配位键,用箭号表示)
(若有配位键,用箭号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)>c(CH3C00-) | |
| B. | 将PH=a的醋酸稀释为pH=a+1的过程中,C(OH-)不断增大 | |
| C. | 等体积pH=a的盐酸与pH=b的氨水溶液恰好中和时,a+b=14 | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(H+)=c(NH4+)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com