
| A. | 胃酸过多的病人,可以服用氢氧化钠来中和胃酸 | |
| B. | 晶体硅是在通信工程中制作光导纤维的主要原料 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存 | |
| D. | 二氧化硅与氢氟酸的反应原理可用来雕刻玻璃 |
分析 A.胃酸的主要成分是HCl,能和NaOH反应生成盐和水,但NaOH具有强腐蚀性;
B.光导纤维的主要成分是SiO2;
C.常温下,干燥的氯气和Fe不反应;
D.SiO2能和HF反应生成SiF4.
解答 解:A.胃酸的主要成分是HCl,能和NaOH反应生成盐和水,但NaOH具有强腐蚀性,应该Al(OH)3、NaHCO3等物质治疗胃病,故A错误;
B.光导纤维的主要成分是SiO2,Si能作硅芯片、硅太阳能电池等,故B错误;
C.常温下,干燥的氯气和Fe不反应,所以常温下干燥的Cl2能用钢瓶贮存,故C正确;
D.SiO2能和HF反应生成SiF4,反应方程式为SiO2+4HF=SiF4+2H2O,所以二氧化硅与氢氟酸的反应原理可用来雕刻玻璃,故D正确;
故选AB.
点评 本题考查物质的用途,为高频考点,明确物质性质是解本题关键,性质决定用途,易错选项是A,注意:治疗疾病时不能引起二次伤害,题目难度不大.


科目:高中化学 来源: 题型:选择题
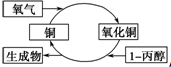
| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
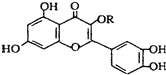
| A. | 可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质与H2加成耗H2最大量为8 mol | |
| D. | 维生素P遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以使纯水中的c(H+)>c(OH-) | |
| B. | 在NaOH溶液中没有H+,在HCl溶液中没有OH- | |
| C. | 水的电离过程是一个吸热过程 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 常温常压下,18 g H2O中含有2nA个氢原子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
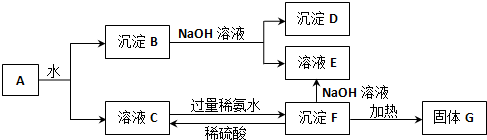
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
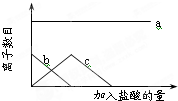 向一定量的Na2CO3溶液中缓慢滴入稀盐酸,并不断搅拌,随着盐酸的加入,溶液中自由离子的数目也随之发生如图所示变化.坐标系中a、b、c三条曲线分别对应的离子是( )
向一定量的Na2CO3溶液中缓慢滴入稀盐酸,并不断搅拌,随着盐酸的加入,溶液中自由离子的数目也随之发生如图所示变化.坐标系中a、b、c三条曲线分别对应的离子是( )| A. | Na+ CO32- H+ | B. | Cl-Na+ CO32- | ||
| C. | Na+HCO3- CO32- | D. | Na+ CO32- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3中:c(Na+)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | Na2CO3溶液:c(OH-)═c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:c(H+)+c(M+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
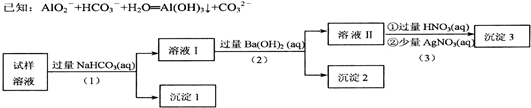
| A. | 试样溶液中若(1)加入的是稍过量的FeCl3溶液,则沉淀1物质的成分不变 | |
| B. | 试样溶液中肯定存在阴离子A1O2-、C1-,阳离子NH4+、K+至少存在1种 | |
| C. | 上述沉淀2放置在干燥空气中一段时间后,称量质量没有变化,可判断试样中无SO32- | |
| D. | 实验中,如果将操作(1)与(3)所加的试剂互换,过程中的实验现象仍会完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com