
【题目】已知:①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1 ②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2 下列推断正确的是( )
A.若CO的燃烧热为ΔH3,则H2的燃烧热为ΔH3-ΔH1
B.反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=ΔH1-ΔH2
C.若反应②的反应物总能量低于生成物总能量,则ΔH2<0
D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH1<0
【答案】D
【解析】
A.若CO的燃烧热为ΔH3,则③CO(g)+![]() O2(g)=CO2(g) ΔH3,③-①,整理可得H2(g)+
O2(g)=CO2(g) ΔH3,③-①,整理可得H2(g)+![]() O2(g)=H2O(g) ΔH=ΔH3-ΔH1,由于H2O的稳定状态是液态,因此该反应不能表示氢气的燃烧热,A错误;
O2(g)=H2O(g) ΔH=ΔH3-ΔH1,由于H2O的稳定状态是液态,因此该反应不能表示氢气的燃烧热,A错误;
B.①-②,整理可得CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=ΔH2-ΔH1,B错误;
C.若反应②的反应物总能量低于生成物总能量,则该反应是吸热反应,ΔH2>0,C错误;
D.③CO(g)+![]() O2(g)=CO2(g) ΔH3, ④H2(g)+
O2(g)=CO2(g) ΔH3, ④H2(g)+![]() O2(g)=H2O(g) ΔH4,若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH3<ΔH4,③-④,整理可得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1=ΔH3-ΔH4<0,D正确;
O2(g)=H2O(g) ΔH4,若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH3<ΔH4,③-④,整理可得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1=ΔH3-ΔH4<0,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
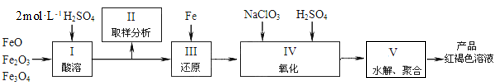
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
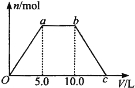
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化工中3,5-二甲氧基苯酚是重要的有机合成中间体,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)1mol间苯三酚完全燃烧需要_____molO2。
(2)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是________。
②萃取用到的分液漏斗分液时有机层在分液漏斗的____填(“上”或“下”)层。
(3)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是__________________________ ;
(4)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_________(填字母)。
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(5)写出反应中可能出现的副产物结构简式______________(只要写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
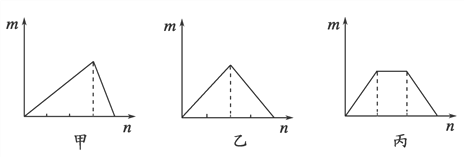
A.符合甲图像的两种反应物可以是AlCl3和NaOH
B.符合乙图像的两种反应物可以是Ca(OH)2和CO2
C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2
D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是


A.图1铁片靠近烧杯底部的部分,腐蚀更严重
B.若M是锌片,可保护铁
C.若M是铜片,可保护铁
D.M是铜或是锌都不能保护铁,是因没有构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.常温下,1L pH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移电子数目为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
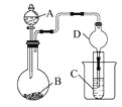
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g)△H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O![]() FeO+N2;反应②______________
FeO+N2;反应②______________
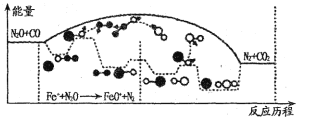
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
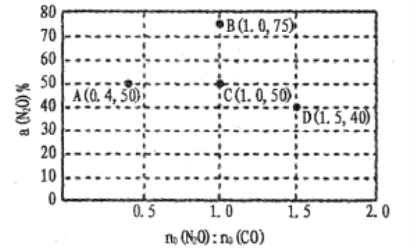
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com