
| A. | 三种元素的原子半径大小为X>Y>Z | B. | Y2-与Z+的半径大小为Y2->Z+ | ||
| C. | Y元素为S | D. | Z 元素为K |
分析 短周期元素X、Y、Z所在的周期数依次增大,Y2-与Z+核外电子层的结构相同,可知二者的离子核外各有10个电子,根据Y与Z的化合价,可知Y、Z分别属于ⅥA和IA族元素,Y的原子序数为8,属于O元素,Z的原子序数为11,属于Na元素,再根据三者原子序数之和为20,可知X为H元素,以此解答该题.
解答 解:短周期元素X、Y、Z所在的周期数依次增大,Y2-与Z+核外电子层的结构相同,可知二者的离子核外各有10个电子,根据Y与Z的化合价,可知Y、Z分别属于ⅥA和IA族元素,Y的原子序数为8,属于O元素,Z的原子序数为11,属于Na元素,再根据三者原子序数之和为20,可知X为H元素,
A.原子核外电子层数越多,原子半径越大,应为Z>Y>X,故A错误;
B.Y2-与Z+的核外电子排布相同,核电荷数越大离子半径越小啊,故B正确;
C.Y为O元素,故C错误;
D.Z为Na元素,故D错误.
故选B.
点评 本题考查原子结构和元素周期律,侧重考查分析推断能力,明确物质结构、元素周期律即可解答,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
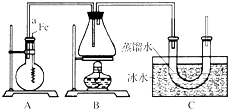 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向次氯酸钙溶液中通入二氧化碳气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通入二氧化硫气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 用惰性电极电解CuSO4溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+2H+═Ca2++CO2↑+H2O | 将少量CaCO3粉末投入足量硝酸溶液中 CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com