
��6�֣������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ��/��mol��L��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
��1����ʵ���д��HA�ĵ��뷽��ʽ�� ��
��2�����¸��վ�ѡ���������������
ʵ��ڷ�Ӧ�����Һ�У�c(A��)��c(HA) 0.1mol��L��1
�����£���pH��3��HA��Һϡ�͵�ԭ�����10������Һ��pH 4
����ʱ��������pH��a�������pH��b��HA��Һ�зֱ����������������ƺ�����Һ�������ԣ���a b
��3��20 mL 0.1 mol/L NaA��Һ��10 mL 0.1 mol/L HCl��Һ��Ϻ���Һ�����ԣ�������Һ������Ũ���ɴ�С��˳���� ��
(1) HA  H+ +A- (2) �� �� �� (3) c(Na��) >c(A��)>c(Cl��)> c(H��)> c(OH��)
H+ +A- (2) �� �� �� (3) c(Na��) >c(A��)>c(Cl��)> c(H��)> c(OH��)
��������
�����������1�����ʵ���Ũ��������HA���������ػ�ϣ�����ǡ�÷�Ӧ�����Σ������Һ�ʼ��ԣ�˵�����ɵ�����ǿ�������Σ���HA�������2��KA��ǿ�������Σ�����Һ�ʼ��ԣ�Ҫʹ�������Һ�����ԣ�����Ӧ������������������ʵ���Ũ��Ӧ�Դ���0.1mol/L�����������غ�ɵã�c(A��)��c(HA) ��0.1mol��L��1�������£���pH��3��HA��Һ����ϡ�ͣ�ϡ�����У�HA�ĵ���ƽ���������ƶ�������������Ũ�ȵļ�С�̶ȣ���ϡ�͵�ԭ�����10����������Ũ�ȴ���ԭŨ�ȵ�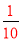 ��PH��4������ʱ��������pH��a�������pH��b��HA��Һ�зֱ����������������ƺ�����Һ�������ԣ�����������������ǡ����ȫ�кͣ�HA������������ΪHCl��ǿ����ʣ���ȫ���룬HA��������ʣ������룬������������Ũ�ȴ���HA��a����ʱ��������pH��a�������pH��b��HA��Һ�зֱ����������������ƺ�����Һ��������a��b����3��20 mL 0.1 mol/L NaA��Һ��10 mL 0.1 mol/L HCl��Һ��Ϻõ���Ũ�ȵ�NaA��NaCl��HA�Ļ����Һ����Һ�����ԣ���Һ�����ԣ���NaA��ˮ��̶�С��HA�ĵ���̶ȣ���������Һ������Ũ���ɴ�С��˳���ǣ�c(Na��) >c(A��)>c(Cl��)> c(H��)> c(OH��)��
��PH��4������ʱ��������pH��a�������pH��b��HA��Һ�зֱ����������������ƺ�����Һ�������ԣ�����������������ǡ����ȫ�кͣ�HA������������ΪHCl��ǿ����ʣ���ȫ���룬HA��������ʣ������룬������������Ũ�ȴ���HA��a����ʱ��������pH��a�������pH��b��HA��Һ�зֱ����������������ƺ�����Һ��������a��b����3��20 mL 0.1 mol/L NaA��Һ��10 mL 0.1 mol/L HCl��Һ��Ϻõ���Ũ�ȵ�NaA��NaCl��HA�Ļ����Һ����Һ�����ԣ���Һ�����ԣ���NaA��ˮ��̶�С��HA�ĵ���̶ȣ���������Һ������Ũ���ɴ�С��˳���ǣ�c(Na��) >c(A��)>c(Cl��)> c(H��)> c(OH��)��
���㣺������ʵĵ��롢����ˮ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A����CO2ͨ��BaCl2��Һ�������ͣ�������������ͨ��SO2����������
B����ϡ�����м���ͭ�ۣ�ͭ�۲��ܽ⣻�ټ���Cu(NO3)2���壬ͭ���Բ��ܽ�
C����AlCl3��Һ�еμӰ�ˮ��������ɫ�������ټ������NaHSO4��Һ��������ʧ
D����п��ϡ���ᷴӦ�������������ʽ������ټ�������CuSO4���壬���ʲ��ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣�����������Na+��K+��Cu2+��H+��NO3����Cl����CO32����OH�������ܴ���������ͬһ��Һ������������Ƿֳ�A��B���飬��֪A����Һ�����ԣ���ÿ���о������������Ӻ����������ӣ�
A�飺 ��
B�飺
��д�����й��̷�Ӧ�����ӷ���ʽ��
��1�������ʯ��ˮ�еμ�����NaHCO3��Һ�� ��
��2����Na2CO3��Һ��ͨ������CO2���壺 ��
��3����������Һ�У���μ���Ba(OH)2��Һ��SO42��������ȫ�� ��
��4����1L 1.0mol?L��1��NaOH��Һ����0.7molCO2���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ��������ϰ�ࣩ10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(16��)ij����С������H2��ԭ��ɫ��WO3��ĩ�ⶨW�����ԭ����������ͼ�Dzⶨװ�õ�ʾ��ͼ��A�е��Լ������ᡣ

��ش��������⣺
��1��������װ����Լ���B_________ ��D___________��
��2�����Ӻ�װ�ú�Ӧ����_________________________������д������
��3�������ȷ�Ӧ��E���͡���Aƿ��εμ�Һ�塱����������Ӧ���Ƚ��е��� _______________����������֮�仹Ӧ���еIJ�����____________________________
��4��д����Ӧ�����з�Ӧ��E�еĻ�ѧ����ʽ��_______________ ��
��5����ʵ���в������������
�ٿ�E�ܵ�����a �� ��E�ܺ�WO3��������b ���۷�Ӧ��E�ܺ�W�۵�������c����ȴ�����³��������ܷ�ӦǰF�ܼ���ʢ���������d ���ݷ�Ӧ��F�ܼ���ʢ���������e
���������ݿ����г�����W�����ԭ��������������ͬ����ʽ����W�⣬�����漰��Ԫ�ص����ԭ��������Ϊ��֪����
����ʽ1��Ar(W)��____________������ʽ2��Ar(W)��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ��������ϰ�ࣩ10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
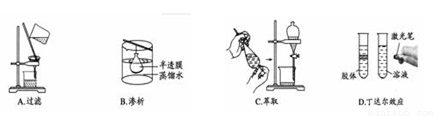
����ʵ������������С��ֱ�ӹ�ϵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A��pH��ȵ�CH3COONa��NaOH��Na2CO3������ҺŨ�ȴ�С��ϵΪ��c(NaOH)��c(CH3COONa)��c(Na2CO3)
B��0.1 mol/L��NaHA��Һ����pH��4��c(HA��)��c(H��)��c(H2A)��c(A2��)
C��������������ʵ���Ũ�ȵ�NaX������HX��Ϻ����Һ��c(Na��)��c(HX)��c(X��)��c(H��)��c(OH��)
D��pH��11��NaOH��Һ��pH��3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ������ȷ����
A����Ư����Һ��ͨ������CO2�����ӷ���ʽ: 2ClO����CO2��H2O===2HClO��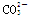
B����ͭΪ�缫��ⱥ��ʳ��ˮ��2Cl����2H2O Cl2����H2����2OH��
Cl2����H2����2OH��
C��50 mL 1mol/L��NaOH��Һ��ͨ��0.03 mol H2S��5OH����3H2S��HS����2S2����5H2O
D��̼����þ��Һ�м������ʯ��ˮ��Mg2+��2HCO3����Ca2+��2OH����CaCO3����MgCO3����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ���������ѧУ������ѧ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ⷨ�������Ժ�����ˮ(��Ҫ����Cr2O72��)ʱ�����������������������������д��ڷ�ӦCr2O72����6Fe2����14H����2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ������˵������ȷ����
A��������ӦΪFe��2e��===Fe2��
B������������ҺpH������
C����������Fe(OH)3��������
D����·��ÿת��12 mol���ӣ������2 mol Cr2O72������ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��nAΪ�����ӵ���������ֵ������˵����ȷ����( )
A�����³�ѹ�£�8 g O2����4nA������
B��1 L 0.1 mol��L��1�İ�ˮ����nA��NH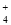
C����״���£�22.4 L���Ậ��nA��HCl����
D��1 mol Na����ȫ��������Na2O2��ʧȥ��2nA����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com