
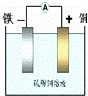
如图:利用Fe+CuSO4=FeSO4+Cu反应设计一个原电池.下列说法中,正确的是( )
|
| A. | 电解质溶液中阳离子向负极移动 |
|
| B. | 电子通过溶液由负极流向正极 |
|
| C. | 当导线中有1mol电子通过时,理论上正极消耗28克. |
|
| D. | 若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过 |
考点:
原电池和电解池的工作原理.
分析:
A.电解质溶液中阳离子向正极移动,阴离子向负极移动;
B.电子不能通过溶液;
C.当有1mol电子通过时,正极析出铜的质量为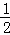 mol×64g/mol=32g;
mol×64g/mol=32g;
D.当有1mol电子通过时,负极铁的质量减少为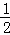 mol×56g/mol=28g,正极析出铜的质量为
mol×56g/mol=28g,正极析出铜的质量为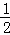 mol×64g/mol=32g,质量差为60g.
mol×64g/mol=32g,质量差为60g.
解答:
解:A.电解质溶液中阳离子向正极移动,阴离子向负极移动,故A错误;
B.原电池工作时,电子从负极经外电路流向正极,不能通过溶液,故B错误;
C.当有1mol电子通过时,正极析出铜的质量为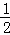 mol×64g/mol=32g,故C错误;
mol×64g/mol=32g,故C错误;
D.当有1mol电子通过时,负极铁的质量减少为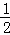 mol×56g/mol=28g,正极析出铜的质量为
mol×56g/mol=28g,正极析出铜的质量为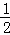 mol×64g/mol=32g,质量差为60g,故D正确;
mol×64g/mol=32g,质量差为60g,故D正确;
故选D.
点评:
本题考查原电池的设计及其原理的判断,题目难度中等,注意有关基础知识的积累,掌握电极方程式的书写.


科目:高中化学 来源: 题型:
由葡萄糖发酵可得乳酸,为研究乳酸的分子组成和结构,进行了下述实验:
(1)称取乳酸09 g,在某种状况下使其完全气化,相同状况下同体积的H2的质量为002 g,则乳酸的相对分子质量为 g。
(2)若将上述乳酸蒸气在氧气中燃烧只生成CO2和H2Og),当全部被碱石灰吸收时,碱石灰的质量增加186 g;若将此产物通入过量石灰水中,则产生300 g白色沉淀。则乳酸的分子式为 。
(3)另取090 g乳酸,若与足量金属钠反应,生成H2 2224 mL(标准状况),若与足量碳酸氢钠反应,生成112 mL CO2(标准状况),则乳酸的结构简式可能为 
或 。
(4)若葡萄糖发酵只生成乳酸,其反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效: ClO-+CO2+H2O=HClO+HCO3-
B.NaAlO2溶液中通 入过量CO2制Al(OH)3:AlO2-+CO2+2H2O =Al(OH)3↓+HCO3-
入过量CO2制Al(OH)3:AlO2-+CO2+2H2O =Al(OH)3↓+HCO3-
C.用浓盐酸与MnO2反应制少量氯气:MnO2+2H++2Cl-  Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.强碱溶液中NaClO与Fe(OH)3制Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
有以下六种元素:A是宇宙中最轻的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3P轨道后,3P轨道呈全充满状态。G原子2P轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数差8.
L位于周期表第四周期、第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示,

请回答下列问题:
(1) E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2) G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3) M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则
在M2E2分子中M原子的杂化类型是______,M2E2是_______(填“极性”或“非极性”)分子。
(4) L的外围电子排布式为________,该元素位于周期表中的________族。
(5) R的化学式为____________(用元素符号表示),属于________晶体。
已知R晶体的密度为ρ g.cm-3,则该晶胞的边长a________cm。(阿常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的性质比较中,不正确的是( )
|
| A. | 酸性 HClO4>HBrO4>HIO4 | B. | 碱性Ba(OH)2>Ca(OH)2>Mg(OH)2 |
|
| C. | 还原性 F﹣>Cl﹣>Br﹣ | D. | 稳定性 HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量.已知单质C(s)的燃烧热为Y kJ/mol,则1mol C(s)与O2(g)反应生成CO(g)的反应热△H为( )
|
| A. | ﹣Y kJ/mol | B. | ﹣(10X﹣Y)kJ/mol |
|
| C. | ﹣(5X﹣0.5Y) kJ/mol | D. | +(10X﹣Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知;N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣543kJ•mol﹣1
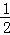 H2(g)+
H2(g)+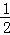 F2(g)=HF(g)△H=﹣269kJ•mol﹣1
F2(g)=HF(g)△H=﹣269kJ•mol﹣1
H2(g)+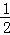 O2(g)=H2O(g)△H=﹣242kJ•mol﹣1
O2(g)=H2O(g)△H=﹣242kJ•mol﹣1
(1)肼和二氧化氮反应的热化学方程式为
(2)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
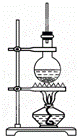
如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8g硬脂酸甘油酯,然后加入2~3g的氢氧化钠、5mL水和10mL酒精;加入酒精的作用为 .
(2)向所得混合物中加入 ,静置一段时间,溶液分为上下两层,肥皂在 层.
(3)图中长玻璃管的作用是 .
(4)写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图中的实验方案,能达到实验目的是()
A B C D
实验
方案 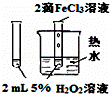
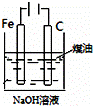

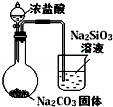
实验
目的 验证FeCl3对H2O2分解反应有催化作用 制备Fe(OH)2并能较长时间观察其颜色 除去CO2气体中混有的SO2 比较HCl、H2CO3和H2SiO3的酸性强弱
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com