
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.分析 根据元素在周期表中的位置可知,①为H元素,②为C元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为S元素,⑨为Cl元素,
(1)主族元素周期数等于电子层数,族序数等于最外层电子数;
(2)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(3)元素①④⑨以原子个数比1:1:1形成的化合物为HClO,分子中O原子与Cl原子、H原子之间分别形成1对共用电子对;元素⑤和⑧形成硫化钠,为离子化合物,根据离子化合物的电子式结合电子转移然后写出Na2S的形成过程;
(4)元素⑤和⑥最高价氧化物水化物反应为氢氧化钠与氢氧化铝的反应,生成偏铝酸钠和水;
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应,为碳和浓硫酸的反应,生成二氧化碳、二氧化硫、水;根据n=$\frac{N}{{N}_{A}}$结合方程式进行计算;
(6)同一方程式中,氧化剂的氧化性强于氧化产物,氯气能氧化硫化氢生成硫单质.
解答 解:(1)⑥为Al元素,原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为 ,位于周期表中第三周期第ⅢA族,
,位于周期表中第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)电子层一样多的原子,核电荷数越多半径越小,Na+为10电子离子,S2-和Cl-均为18电子阴离子,故S2->Cl-,Na+为2个电子层,故半径小于Cl-,即S2->Cl->Na+,
故答案为:S2->Cl->Na+;
(3)元素①④⑨以原子个数比1:1:1形成的化合物为HClO,分子中O原子与Cl原子、H原子之间分别形成1对共用电子对,其结构式为H-O-Cl,电子式为: ,元素⑤和⑧形成硫化钠,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为:
,元素⑤和⑧形成硫化钠,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: .
.
故答案为: ;
; ;
;
(4)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应,浓硫酸具有强的氧化性,与碳发生反应生成二氧化碳、二氧化硫和水.反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,该反应中C(0→+4),每生成3mol气体转移4mol电子,若反应中有6.02×1023个电子发生转移,n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}}$=1mol,则生成0.75mol气体,则生成的气体标准状况下的体积为V=nVm=0.75mol×22.4L/mol=16.8L,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;16.8L;
(6)氯气能氧化硫化氢生成硫单质,反应方程式为Cl2+H2S=S+2HCl,非金属性S<Cl,
故答案为:Cl2+H2S=S+2HCl.
点评 本题考查了元素周期表与元素周期律的综合应用,根据元素周期表中的位置确定元素,再根据物质的性质及物质之间的反应来分析解答,题目难度中等,注意掌握元素周期律内容、元素周期表结构,试题培养学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治疗疟疾的青蒿素(如图),分子式为C15H20O5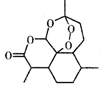 | |
| B. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 | |
| C. | 对三联苯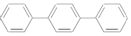 分子中至少有16个原子共平面 分子中至少有16个原子共平面 | |
| D. | 油脂和乙烯在一定条件下都能与水反应,且反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求回答问题:
按要求回答问题: ;
;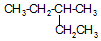 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成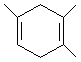 ,所用的原料可以是
,所用的原料可以是 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
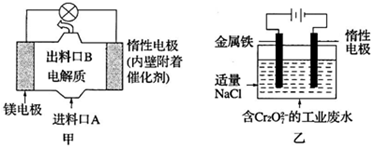
| A. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ | |
| C. | 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生 | |
| D. | 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com