
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
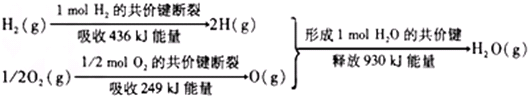
分析 反应的焓变=反应物键能之和-生成物的键能之和=436kJ+249kJ-930kJ=-245kJ,所以反应是放热反应,反应的热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245kJ/mol,
A.氢气与氧气燃烧生成水的反应为放热反应;
B.依据化学键的键能以及可逆反应的热效应相反分析判断;
C.物质的聚集状态影响能量变化;
D.焓变与化学计量数成正比,据分析中的热化学方程式判断.
解答 解:反应的焓变=反应物键能之和-生成物的键能之和=436kJ+249kJ-930kJ=-245kJ,所以反应是放热反应,反应的热化学方程式为H2(g)+1/2O2(g)=H2O(g)△H=-245kJ/mol,
A.根据分析可知,氢气的燃烧即有水生成同时放出热量,故A正确;
B.根据以上计算可知,氢气与氧气反应生成水是放热反应,故B错误;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245kJ,气态水变为液态水时放出热量,生成若是液态水,则释放能量大于245kJ,故C正确;
D.根据分析可知,1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245kJ,则2mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ,故D正确;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度中等,注意明确旧键断裂吸热热量,新键形成放出热量,要求学生能够依据化学键的键能来计算判断吸热反应和放热反应,即反应的热效应=反应物的键能之和-生成物的键能之和.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氰酸钾溶液 | B. | NaOH溶液 | ||
| C. | 新制氯水、硫氰酸钾溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
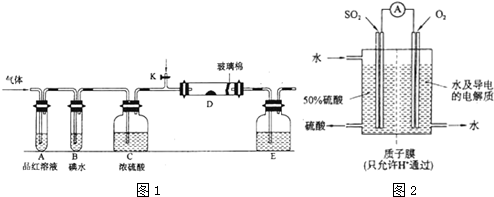
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com