
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测
氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_______________________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是______________________________________。
答案 方案一:2Al+2NaOH+2H2O===2NaAlO2+3H2↑ (1)97 (2)偏高
方案二:(1)E D G
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 ②(V1-V2) ③实验时的温度和压强
解析 方案一:将铝镁合金与足量NaOH溶液反应,镁不和NaOH溶液反应,铝发生反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
(1)假设合金中镁的质量分数最少为3%,则10.8 g铝镁合金粉末样品中含有铝10.476 g,其物质的量是0.388 mol,根据反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑知,需要n(NaOH)=n(Al)=0.388 mol,V(NaOH)=0.388 mol/4.0 mol·L-1=0.097 L。
(2)过滤后,金属镁的表面会沾有其他离子,如果没有洗涤,称量后的固体的质量将大于镁的实际质量,所测得镁的质量分数将偏高。
方案二:
(1)很明显,该同学采用排水法来测量产生氢气的体积,故A应连接E,D连接G。(最后读数时要调节广口瓶和量筒中的液面高度,F接口的导管太短)。(2)①用导管a连接后,滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;②量气管的 0刻度在上,故产生氢气的体积为(V1-V2) mL;③若需确定产生氢气的量,还需知道实验时的温度和压强。


科目:高中化学 来源: 题型:
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2)____P4+____KOH+____H2O===____K3PO4+____PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
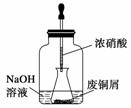
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式____________。
(2)上图装置中NaOH溶液的作用是_____________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CH4、CCl4中键长相等,键角不同
D. 中的键能是C—C中的键能的两倍
中的键能是C—C中的键能的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在0 ℃、1.01×105 Pa时进行下列实验:甲、乙、丙三位同学各取30.0 mL同浓度的盐酸,加入相同组成的镁铝合金粉末,测定产生气体的体积,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
试求:(1)盐酸的物质的量浓度是多少?
(2)合金中各成分的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样( )
(3)干燥环境下金属不被腐蚀( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com