
| A. | 0.45mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
分析 A转化得到B,其中部分B又转化得到C与D,平衡时各物质的浓度是c(A)=0.3mol/L,c(B)=0.2mol/L,c(C)=0.05mol/L,则转化为C时B的浓度变化量为2×0.05mol/L=0.1mol/L,则A转化得到B的总浓度为0.2mol/L+0.1mol/L=0.3mol/L,结合方程式计算A的起始浓度,再根据n=cV计算,
解答 解:A转化得到B,其中部分B又转化得到C与D,平衡时各物质的浓度是c(A)=0.3mol/L,c(B)=0.2mol/L,c(C)=0.05mol/L,则转化为C时B的浓度变化量为2×0.05mol/L=0.1mol/L,故A的起始浓度为:0.3mol/L+$\frac{1}{2}$×(0.2mol/L+0.1mol/L)=0.45mol/L,则最初向容器里加入A的物质的量是2L×0.45mol/L=0.9mol,
故选:C.
点评 本题考查化学平衡计算,关键是计算A转化得到B的浓度,难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 将某无色无味的气体通入澄清石灰水中 | 生成白色沉淀 | 该气体一定是CO2 |
| C | 往某溶液中加入AgN03溶液 | 生成白色沉淀 | 溶液中一定含有Cl- |
| D | 往某溶液中加入KSCN溶液 | 溶液呈血红色 | 溶液中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
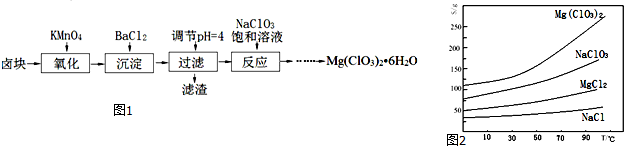
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | 5 | 8 | |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 4.5 mol | C. | 5mol | D. | 7.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3 | B. | 0.5mol H3PO4 | C. | 1mol O2 | D. | 3.01×1023个CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com