
| A、Cu2+、H+、Cl- |
| B、CO32-、OH- Cl- |
| C、K+、H+、Cl- |
| D、K+、CO32-、OH- |


科目:高中化学 来源: 题型:
| A、1 mol/L氢氰酸溶液的pH约为3 |
| B、常温下,pH=a的HCN稀释100倍后所得溶液pH<(a+2)[(a+2)<7] |
| C、10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、NaCN溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
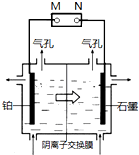 制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )| A、M是电源的负极 | ||||
| B、左侧气孔逸出的气体可能为副产物H2 | ||||
C、电解槽中发生的总反应为:MnSO4+2H2O
| ||||
| D、若用阳离子交换膜代替阴离子交换膜,阳极可能得到 MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
| C、澄清石灰水与碳酸钠溶液混合:Ca(OH)2+CO32-=CaCO3↓+2OH- |
| D、用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A、外电路的电流方向为:X→外电路→Y |
| B、若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中氢离子向Y极移动,硫酸根向X极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
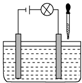 在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A、盐酸中逐滴加入食盐溶液 |
| B、醋酸中逐滴加入氢氧化钠溶液 |
| C、饱和石灰水中不断通入CO2 |
| D、醋酸中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

| 实验编号 | 窗口体积/L | 温度/℃ |
| ① | 1.0 | 1200 |
| ② | 2.0 | 1200 |
| ③ | 2.0 | 1300 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com