
分析 (1)根据m(溶质)=m(溶液)×ω(溶质)计算原不同浓度溶液中硝酸钠的质量,再根据ω=$\frac{溶质质量}{溶液质量}$×100%计算混合后溶液中硝酸钠的质量分数;
(2)根据c=$\frac{1000ρw}{M}$计算混合溶液中NaNO3的物质的量浓度.
解答 解:(1)混合后溶液硝酸钠总质量为:40g×10%+60g×7.5%=8.5g,
混合后溶液中硝酸钠的质量分数为:$\frac{8.5g}{40g+60g}$×100%=8.5%;
答:混合溶液中溶质的质量分数是8.5%;
(2)混合溶液的密度为1.20g/cm3,硝酸钠的质量分数为8.5%,则混合后硝酸钠的物质的量浓度c=$\frac{1000×1.2×8.5%}{85}$mol/L=1.2mol/L,
答:混合溶液中NaNO3的物质的量浓度是1.2mol/L.
点评 本题考查质量分数、物质的量浓度的有关计算,难度不大,注意对公式的理解与灵活运用,掌握质量分数与物质的量浓度的关系.


科目:高中化学 来源: 题型:实验题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能热水器,太阳能电池、由玉米制乙醉部涉及生物质能的利用 | |
| B. | “地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油 | |
| C. | 以淀粉浓液作指示剂,用已知浓度的碘溶液来测定食品中SO2的残留量 | |
| D. | 雾霾属于分散系,减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的CO、N2含有的分子数均为NA | |
| B. | 0.5 mol/L的MgCl2溶液中Cl-离子的物质的量为NA | |
| C. | 常温常压时,4.48 L CH4气体中含有的原子数大于NA | |
| D. | 12克13C含有的碳原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
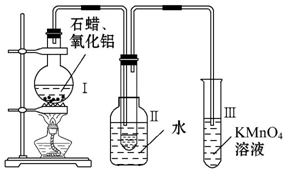 某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(D)=0.4 mol/(L•s) | B. | υ(C)=30 mol/(L•min) | C. | υ(B)=0.9 mol/(L•s) | D. | υ(A)=0.15 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | Na2CO3+H2SO4;Na2CO3+HCl | ||
| C. | CaCO3+H2SO4;CaCO3+HCl | D. | BaCl2+H2SO4;Ba(OH)2+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com