
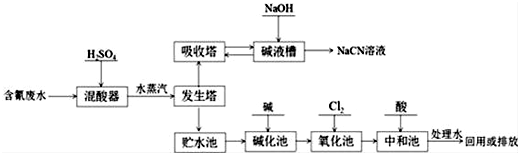
 .
.分析 含氰废水加入稀硫酸在混酸器中反应得到氰酸,通过水蒸气在发生塔中促使HCN挥发进入吸收塔,被氢氧化钠溶液吸收得到NaCN溶液,发生塔中剩余废水先经碱化后再进行氧化,CN-被氯气氧化成低毒的CNO-,CNO-被氯气氧化成无毒的两种气体氮气和二氧化碳,然后加入酸进行中和过滤的碱溶于,处理水回用或排放,
(1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键;
(2)氰化钠易发生水解产生氰化氢;
(3)向发生塔中通水蒸汽可以将产物吹出;
(4)CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子;CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,据此书写方程式;
(5)氢氰酸属于酸,可以和碱之间发生反应;
(6)电解池的阴极上发生得电子的还原反应;根据Ag+和CN-可以结合成稳定的络合物来回答.
解答 解:(1)CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ,故答案为:
,故答案为: ;
;
(2)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(3)向发生塔中通水蒸汽的目的是促使HCN挥发进入吸收塔,故答案为:促使HCN挥发进入吸收塔;
(4)CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子,即CN-+Cl2+2OH-=CNO-+2Cl-+H2O;CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,即2CNO-+3Cl2+8OH-=N2↑+2CO32-+6Cl-+4H2O,
故答案为:CN-+Cl2+2OH-=CNO-+2Cl-+H2O;2CNO-+3Cl2+8OH-=N2↑+2CO32-+6Cl-+4H2O;
(5)贮水池中废水须先经碱化后再进行氧化,这样可以防止生成HCN,故答案为:防止生成HCN;
(6)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:[Ag(CN)2]-+e-=Ag+2CN-,工业电镀中使用氰离子,这样Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,
故答案为:[Ag(CN)2]-+e-=Ag+2CN-;Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密.
点评 本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及氧化还原反应等,明确该反应中的生成物是解本题关键,还可以结合原子守恒、转移电子守恒来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙酸、四氯化碳 | B. | 苯、乙醇、冰醋酸 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
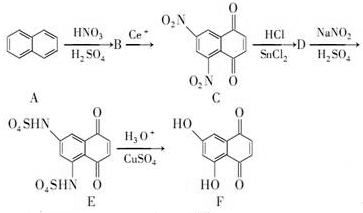
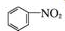 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$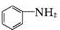 +SnCl4
+SnCl4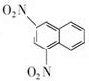 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com