
| A. | v(O2)=0.001mol•L-1•s-1 | B. | v(NO)=0.0015 mol•L-1•s-1 | ||
| C. | v(H20)=0.003 mol•L-1•s-1 | D. | v(NH3)=0.001 mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),一分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=$\frac{\frac{0.3mol}{5L}}{60s}$=0.001mol/(L•s).在根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.
解答 解:一分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=$\frac{\frac{0.3mol}{5L}}{60s}$=0.001mol/(L•s).
A、根据速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.001mol/(L•s)=0.00125mol/(L•s),故A错误;
B、一分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=$\frac{\frac{0.3mol}{5L}}{60s}$=0.001mol/(L•s),故B错误;
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.001mol/(L•s)=0.0015mol/(L•s),故C错误;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.001mol/(L•s),故D正确.
故选D.
点评 本题考查化学反应速率,难度不大,注意反应速率计算常用两种方法定义法与化学计量数法,根据情况选择使用.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性:N<O<F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 热稳定性:HF>HCl>H2S | D. | 原子半径:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
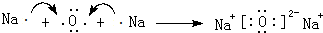 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.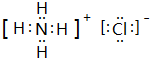 ,A2C2的电子式为
,A2C2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com