
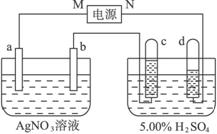
图4-38
(1)直流电源中,M__________为极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与b、c、d各电极分别生成的物质的物质的量之比为:_________∶________∶________∶________。
(4)AgNO3溶液的浓度_______,AgNO3溶液的pH________,H2SO4溶液的浓度______,H2SO4溶液的pH______(填增大、减小或不变)。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
解析:(1)用惰性电极电解H2SO4相当于电解水,观察图中c、d两电极上的小试管,根据气体产生的比例,可推断d电极生成的是H2,而c电极生成的是O2,故M为电源的正极,N为电源的负极。
(2)由反应2H2O![]() 2H2↑+O2↑可知n(H2)∶n(O2)=2∶1,所以该电路中通过的电子物质的量为336 mL/22400 mL·mol-1×2/3×2=0.02 mol。b为Pt电极,也是电解池的阴极,0.02 mol Ag+得0.02 mol电子生成0.02 mol Ag,质量为2.16 g。
2H2↑+O2↑可知n(H2)∶n(O2)=2∶1,所以该电路中通过的电子物质的量为336 mL/22400 mL·mol-1×2/3×2=0.02 mol。b为Pt电极,也是电解池的阴极,0.02 mol Ag+得0.02 mol电子生成0.02 mol Ag,质量为2.16 g。
(3)电源输出的电子为0.02 mol,b电极生成的Ag为0.02 mol,c电极生成的O2为?0.005 mol,d电极生成的H2为0.01 mol,故四者的比值为4∶4∶1∶2。
(4)a电极作阳极,Ag不断溶解进入溶液,能保持AgNO3溶液相对稳定性,所以AgNO3溶液的浓度不变,pH也不变;而由于H2SO4溶液不断被电解,水量减少,使浓度增大,pH减小。
(5)设原有5.00%的H2SO4溶液的质量为x。则:
x×5.00%=(x-336 mL/22400mL·mol-1×2/3×18 g·mol-1)×5.02%
解得:x=0.45 g。
答案:(1)正 (2)Ag 2.16 g (3)4 4 1 2 (4)不变 不变 增大 减小 (5)0.45


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
图4-38中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状态)气体。回答:
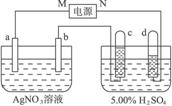
图4-38
(1)直流电源中,M__________为极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与b、c、d各电极分别生成的物质的物质的量之比为:_________∶________∶________∶________。
(4)AgNO3溶液的浓度_______,AgNO3溶液的pH________,H2SO4溶液的浓度______,H2SO4溶液的pH______(填增大、减小或不变)。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
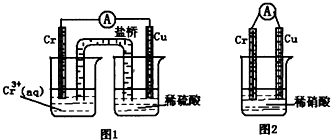
(16分).铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图 1 知金属铬的活动性比铜_____(填强,弱),图 2装置中铬电极的电极反应式
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸, CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为_____________________________________________________________。
(3)存在平衡:2CrO42—(黄色)+2H+Cr2O72—(橙色)+H2O
①若平衡体系的pH=2,则溶液显 色.
②能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的颜色不变
(4)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L1,则溶液中c(Cr3+)为____ mol·L-1。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
从开始加热到 750K 时总反应方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期第一次统练化学试卷 题型:填空题
(16分).铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图 1 知金属铬的活动性比铜_____(填强,弱),图 2装置中铬电极的电极反应式

(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸, CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为_____________________________________________________________。
(3)存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡体系的pH=2,则溶液显 色.
②能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的颜色不变
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L1,则溶液中c(Cr3+)为____ mol·L-1。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

从开始加热到 750K 时总反应方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com