
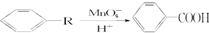 现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )
现有苯的同系物,其蒸气密度为H2的60倍,该烃经氧化后,其产物1mol可中和3mol NaOH,则该烃的结构可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 现有苯的同系物,其蒸气密度为H2的60倍,则其相对分子质量为120,因其为苯的同系物,应符合通式:14n-6=120,n=9,则分子式为C9H12,该烃经氧化后,其产物1mol可中和3molNaOH,说明氧化成三元羧酸,说明苯环上含有三个支链,即三个甲基,从而确定结构.
解答 解:苯的同系物蒸气密度为H2的60倍,则其相对分子质量为120,因其为苯的同系物,应符合通式:14n-6=120,n=9,则分子式为C9H12,该烃经氧化后,其产物1mol可中和3molNaOH,说明氧化成三元羧酸,说明苯环上含有三个支链,即三个甲基,从而确定结构为:
 ,共3种,
,共3种,
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握机物分子式确定、限制条件同分异构体书写,难度不大.


科目:高中化学 来源: 题型:选择题
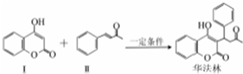
| A. | 物质I的分子式为C9H6O3 | |
| B. | 物质II中处于同一平面上的碳原子最多有7个 | |
| C. | 1mol 华法林最多消耗3mol NaOH | |
| D. | 向反应产物中加入金属钠可检验其中是否有反应物I剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
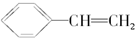 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 它能使溴水褪色,但不能使KMnO4酸性溶液褪色 | |
| B. | 它既能使溴褪色,也能使KMnO4酸性溶液褪色 | |
| C. | 它能发生加聚反应,生成物可用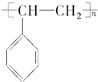 表示 表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中,反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为2Al3++3CO32-═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
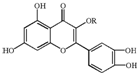 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物最多可与7mol Br2完全反应 | |
| D. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com