
| A、温度越高,K越大 |
| B、压强越大,K越大 |
| C、K越大,反应速率越大 |
| D、K越大,C的百分含量越大 |


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
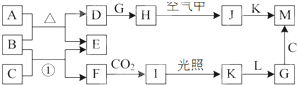
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NCl5 |
| B、NCl4 |
| C、NCl3 |
| D、NCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的原子序数小于Y的原子序数 |
| B、X和Y处在同一周期 |
| C、Y和X的族序数之差是8-(m+n) |
| D、X和Y的核电荷数之差是m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔效应可以区分溶液和胶体 |
| B、一种分散系里只能有一种分散质 |
| C、以水为分散剂的分散系,按稳定性由弱至强的顺序是:浊液?胶体?溶液 |
| D、分散系中分散质粒子直径由大到小的顺序是:浊液?胶体?溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、形成离子键的阴阳离子间只存在静电吸引力 |
| B、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C、元素周期律是元素原子核外电子排布周期性变化的结果 |
| D、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵溶液中加入足量氢氧化钠溶液 NH4++OH-=NH3↑+H2O |
| B、乙酸与氢氧化钠溶液反应 CH3COOH+OH-=CH3COO-+H2O |
| C、盐酸溶液中加入碳酸钙 CO32-+2H+=CO2↑+H2O |
| D、氯化亚铁溶液中通入足量氯气 Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com