
分析 (1)依据溶度积常数概念书写表达式;
(2)氯化镁水解生成氢氧化镁和氯化氢;
(3)除去MgCl2酸性溶液中少量的FeCl3,利用加入的试剂调节溶液PH使铁离子完全沉淀,同时不能引入新的杂质;
(4)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl,依据原子守恒书写化学方程式;
(5)氯化镁水解显酸性,氯化氢气流中加热防止水解.
解答 解:(1)依据溶度积常数概念书写表达式,Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),Ksp=c(Mg2+)•c2(OH-);
故答案为:c(Mg2+)•c2(OH-);
(2)氯化镁水解生成氢氧化镁和氯化氢,其水解的离子方程式为Mg2++2H2O?Mg(OH)2+2H+,
故答案为:Mg2++2H2O?Mg(OH)2+2H+;
(3)除去MgCl2酸性溶液中少量的FeCl3,利用加入的试剂调节溶液PH使铁离子完全沉淀,同时不能引入新的杂质;
a.MgO可以和酸反应调节溶液PH使铁离子沉淀,不引入新的杂质,故a符合;
b.NaOH 能和镁离子、铁离子都能反应,故b不符合;
c.Mg(OH)2 和酸反应调节溶液PH使铁离子沉淀,不引入新的杂质,故c符合;
d.MgSO4和酸不反应,不能调节溶液PH使铁离子沉淀,引入新的杂质离子硫酸根离子,故d不符合;
故答案为:ac;
(4)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl,依据原子守恒书写化学方程式为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑,
故答案为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑;
(5)氯化镁水解显酸性,其水解的离子方程式为Mg2++2H2O?Mg(OH)2+2H+,氯化氢气流中中或加入浓盐酸加热,可抑制Mg2+水解,
故答案为:在干燥的HCl气流中或加入浓盐酸.
点评 本题考查了海水提取镁的工业生产流程分析判断,除杂试剂选择原则,水解原理的分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
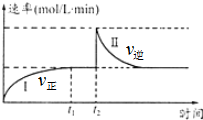 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
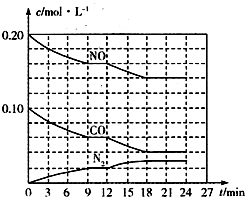 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com