
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a的最高价氧化物对应的水化物是强碱 | |
| D. | b、c、d的气态氢化物的稳定性:b>c>d |
分析 a、b、c、d为短周期元素,a的M电子层有1个电子,应为Na元素;b的最外层电子数为内层电子数的2倍,应为C元素;c的最高化合价为最低化合价绝对值的3倍,应为S元素;c与d同周期,d的原子半径小于c,应为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:a的M电子层有1个电子,应为Na元素,b的最外层电子数为内层电子数的2倍,应为C元素,c的最高化合价为最低化合价绝对值的3倍,应为S元素,c与d同周期,d的原子半径小于c,应为Cl元素,
A.同周期元素从左到右元素的非金属性逐渐增强,元素非金属性强弱顺序为Cl>S>C>Na,即d元素的非金属性最强,故A正确;
B.四种元素形成的氧化物有CO、CO2;Na2O、Na2O2;SO2、SO3,而Cl的化合价有多种,则氧化物也有多种,如ClO2、Cl2O等,故B正确;
C.a为Na,其最高价氧化物对应水合物为氢氧化钠,氢氧化钠为强碱,故C正确;
D.非金属性越强,对应氢化物的稳定性越强,非金属性:Cl>S>C,则气态氢化物的稳定性:d>c>b,故D错误;
故选D.
点评 本题考查了原子结构与元素周期律的关系,侧重于学生的分析能力的培养和原子结构、元素周期率的综合应用的考查,注意把握提给信息以及元素周期率的递变规律,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
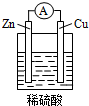 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 电解液的PH值逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
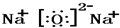 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有还原性,可用于实验室制备氯气 | |
| B. | Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 | |
| C. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| D. | SO2具有漂白性,可用标准KMnO4溶液滴定食品中SO2残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2n molB,同时消耗3n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com