
 �� Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_____���ڣ���______�塣
�� Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_____���ڣ���______�塣
�Ʋ���ټ�����Ŀ����_________________________________________________��
�������ȴ��Ŀ����_________________________________________________��
�� �����Ʊ�TiO2�Ĺ����У��������õĸ�������___________�����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ����_________________������
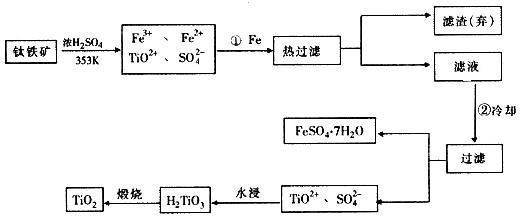
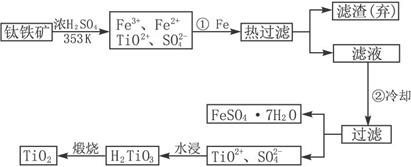
�� �ɽ��ʯ(TiO2)��ȡ����Ti���漰���IJ���Ϊ��
![]()
��֪��
�� C(s) + O2(g) == CO2(g)�� ��H = ��393.5 KJ��mol-1
�� 2CO(g) + O2(g) == 2CO2(g)�� ��H =��566 KJ��mol-1
�� TiO2(s) + 2Cl2(g) == TiCl4(s) + O2(g)�� ��H = +141 KJ��mol-1
��TiO2(s) + 2Cl2(g) + 2C(s)== TiCl4(s) + 2CO(g) �ġ�H = ____________��
��ӦTiCl4 + 2Mg == 2MgCl2 + Ti ��Ar�����н��е�������___________________��
�𰸣�
��1��4 IVB
��2����Fe3+��ԭΪFe2+ ����������롢��õ���FeSO4��7H2O
��3��FeSO4��7H2O ʯ�ң���̼��ơ��ϼ
��4��-80 kJ��mol-1
��ֹ������Mg(Ti)������е�O2����CO2��N2������
������������һ�����͵������ͼ�Ʊ��⡣��������Ի���֪ʶ�����գ�����Ҫ����ѧ��֪ʶ���ۺ�Ӧ��������
��1����ԭ�������ƶ�Ԫ�������ڱ��е�λ�ã��ؼ�����ϤԪ�����ڱ��Ľṹ������������ֹԪ�ص�ԭ����������������λ�õȡ�Ti��ԭ������Ϊ22������Ϥ��Ca��ԭ������Ϊ20���������Ca��Ԫ�����ڱ��е�λ�ã������ƶ�Tiλ�ڵ������ڣ��ڢ�B�塣
��2���ɿ�ͼ��ʾ���̷�����֪��Ҫ��TiO2+��Fe3+��Fe2+���룬��Ҫ�ȼ������۽�Fe3+��ԭΪFe2+�����ȹ��˳�ȥ�������ٽ���Һ��ȴʹFeSO4��7H2O������
��3���Ʊ�TiO2�����еĸ�����FeSO4��7H2O�ڹ�ũҵ�������ճ��������н϶��Ӧ�á��ڷ����H2TiO3�ķ�Һ�У�������������TiO2+��Fe2+���ɼ���ʯ�ң���̼��ơ��ϼ����H+��Ũ�ȣ�ʹ֮ת��Ϊ��������������ѭ�����á�
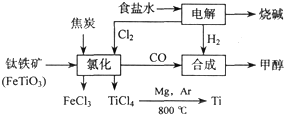
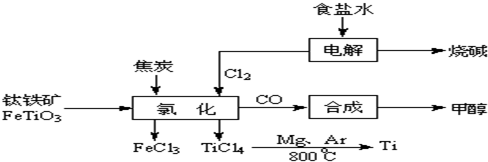
��4����Ӧ��ֻ�뷴Ӧ��ʼ̬����̬�йأ��������ķ�Ӧ���е�;���ء�����֪�Ȼ�ѧ����ʽ��Ӽ���+2���٣��ڵ�TiO2��s��+2Cl2��g��+2C��s��==TiCl4��s��+2CO��g�����䦤H=141 kJ��mol��1+2������393.5 kJ��mol��1��������566 kJ��mol��1��=��80 kJ��mol��1����Ϊ�ڸ����£�Mg��Ti��������е�O2����CO2��N2�����ã�������Mg��ԭTiCl4ʱҪ�ڶ������գ�Ar���н��С�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2MgCl2��s��+Ti����Ar�����н��е������ǣ�
2MgCl2��s��+Ti����Ar�����н��е������ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com