
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:不详 题型:填空题
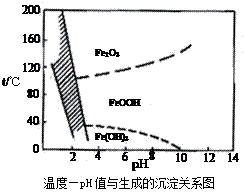
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
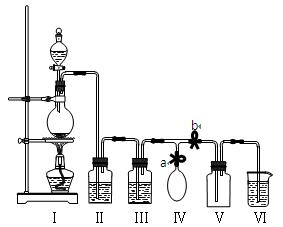
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
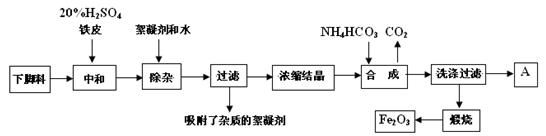

| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
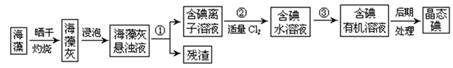
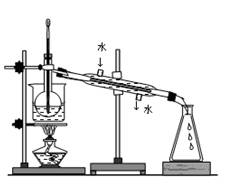
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
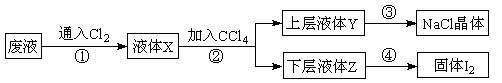
| A.试管 | B.蒸发皿 | C.漏斗 | D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
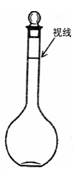
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.200 mL | B.100 mL | C.101 mL | D.120 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com