
| A. |  | B. |  | C. |  | D. | 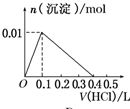 |
分析 向0.1L浓度均为0.1mol/L的NaOH和NaAlO2混合溶液中逐滴加入同浓度的盐酸,首先发生H++OH-=H2O,然后发生AlO2-+H++H2O═Al(OH)3↓,完全生成沉淀后,继续加入盐酸,发生Al(OH)3+3H+═Al3++3H2O,以此解答该题.
解答 解:向0.1L浓度均为0.1mol/L的NaOH和NaAlO2混合溶液中逐滴加入同浓度的盐酸,首先发生H++OH-=H2O,此时加入盐酸0.1L,然后发生AlO2-+H++H2O═Al(OH)3↓,需要盐酸0.1L,完全生成沉淀后,继续加入盐酸,发生Al(OH)3+3H+═Al3++3H2O,需要盐酸0.3L,沉淀完全溶解,只有B符合.
故选B.
点评 本题考查了混合物反应的计算与应用,题目难度中等,明确发生反应的实质为反应的先后顺序为解答关键,试题充分培养了学生的分析、理解能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L H2SO4溶液中含98g H2SO4 | B. | 0.1 L含24.5g H2SO4的溶液 | ||
| C. | 0.5 L水中溶有49g H2SO4 | D. | 98g H2SO4溶于水配成2 L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
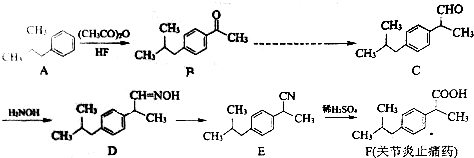
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 | |
| B. | Na2O2用作呼吸面具的供氧剂 | |
| C. | 欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水 | |
| D. | 铝热反应需提供一定的能量引发,因为铝热反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用480 mL容量瓶,称取12.0g硫酸铜,配成480mL溶液 | |
| B. | 选用250 mL容量瓶,称取12.5g胆矾,配成500mL溶液 | |
| C. | 选用500 mL容量瓶,称取12.5g胆矾,加入500mL水 | |
| D. | 选用500 mL容量瓶,称取12.5g胆矾,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .P元素属于p区元素,
.P元素属于p区元素,
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com