
关于键长、键能和键角的说法中不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
★ ★★
科目:高中化学 来源: 题型:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是
C8H10(g)C8H8(g)+H2(g) ΔH=125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是____________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该反应是否达到了平衡状态?________(填“是”或“否”)。
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
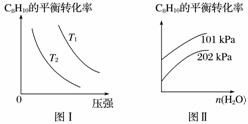
(4)由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,不一定含有非极性共价键
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是_______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO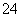 、NO
、NO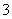
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO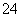
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的虚线框中每一列、每一行相当于元素周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出元素周期表第一至第六周期的轮廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。

查看答案和解析>>
科目:高中化学 来源: 题型:
若某原子在处于能量最低状态时,外围电子排布式为4d15s2,则下列说法正确的是( )
A.该元素原子处于能量最低状态时,原子中共有3个未成对电子
B.该元素原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层共有3个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com