
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L. 
【答案】
(1)![]() KJ/mol
KJ/mol
(2)E1﹣E2
(3)(﹣2c﹣b+a)kJ?mol﹣1;低温
(4)阳;2.24
【解析】解:(1)由于反应热=反应物的键能﹣生成物的键能,设E(H﹣Cl)为Xmol,故有:E(H﹣H)+E(Cl﹣Cl)﹣2X=﹣akJ/mol,即bkJ/mol+ckJ/mol﹣2X=﹣aKJ/mol
解得X= ![]() KJ/mol,所以答案是:
KJ/mol,所以答案是: ![]() KJ/mol;(1)(a+b+c)/2 kJmol﹣1 , (2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
KJ/mol;(1)(a+b+c)/2 kJmol﹣1 , (2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
所以答案是:E1﹣E2;(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
由盖斯定律可知,②+2×③﹣①可得C(石墨,s)+2H2(g)═CH4(g)△H=(﹣2c﹣b+a) kJmol﹣1 ,
又该反应为放热反应,△H<0,又△S<0,所以该反应在低温下△H﹣T△S<0可自发进行;
所以答案是:(﹣2c﹣b+a) kJmol﹣1;低温;(4)装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,当铜片的质量变化为12.8g时物质的量= ![]() =0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
所以答案是:阳;2.24.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.碳酸钙与盐酸反应: ![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.硫酸与氢氧化钡溶液反应:H++ ![]() +Ba2++OH=BaSO4↓+H2O
+Ba2++OH=BaSO4↓+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++ ![]() +Ba2++2OH=BaSO4↓+Cu(OH)2↓
+Ba2++2OH=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质. 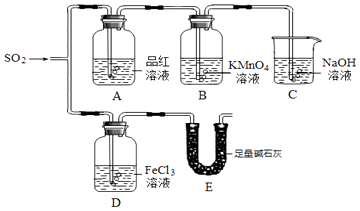
请回答:
(1)仪器E的名称是 . 若没有装置C,将气体直接排放到空气中,会带来的主要环境问题是 .
(2)观察到B中溶液颜色变浅,说明了SO2具有的性质是;
(3)写出仪器D中的实验现象 , 发生氧化还原反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( ) 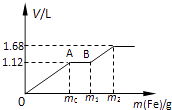
A.开始时产生的气体为H2
B.AB段发生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 molL﹣1
D.参加反应铁粉的总质量m2=5.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Zn+Cu2+= Zn2++ Cu设计成原电池。则该电池的负极、正极和电解质溶液选择合理的是
A. Zn、Cu、ZnSO4B. Cu、Zn、 ZnCl2
C. Cu、Zn、CuCl2D. Zn、Cu、CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列物质性质与应用的对应关系错误的是( )
A.硅胶吸水能力强,可用作食品、药品的干燥剂
B.氢氧化铝碱性不强,可用作胃酸中和剂
C.次氯酸钠具有强氧化性,可用作织物的漂白剂
D.葡萄糖具有氧化性,可用于工业制镜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 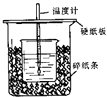
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com