
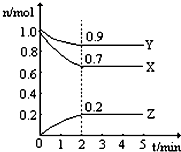
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白:| △c |
| △t |
| 0.2mol |
| 2L×2min |
| 0.3mol |
| 1.0mol |
| 1.8mol |
| 2mol |
| 9 |
| 10 |
| m |
| V |
| m |
| n |


科目:高中化学 来源: 题型:
| A、在氧化还原反应中,阴离子只能发生氧化反应 |
| B、碳酸钠溶液显碱性,碳酸钠是一种碱 |
| C、有些吸热反应不需要加热也能进行 |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果.
废铁屑(含铁锈)可用于地下水脱氮,某课题小组模拟地下水脱氮过程,并研究脱氮原理及脱氮效果.查看答案和解析>>
科目:高中化学 来源: 题型:
 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在容积为VL的密闭容器中发生反应:2NO2?2NO+O2.反应过程中NO2的物质的量随时间变化的情况如图所示.
(1)在容积为VL的密闭容器中发生反应:2NO2?2NO+O2.反应过程中NO2的物质的量随时间变化的情况如图所示.| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②⑥ | C、② | D、②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com