
 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是| A.用物质A表示的反应速率为0.6mol/(L·s) |
| B.用物质B表示的反应速率为0.3mol/(L·s) |
| C.2s时物质B的浓度为0.3mol/L |
| D.2s时物质A的转化率为30% |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源:不详 题型:填空题
 xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成1mol乙酸乙酯的同时,也生成1mol乙酸 |
| B.乙酸、乙醇、乙酸乙酯的浓度相同 |
| C.当乙酸断开1mol碳氧单键的同时,乙醇也断开了1mol氢氧键 |
| D.当乙酸断开1mol氢氧键的同时,乙醇也断开了1mol碳氧单键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
 CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是: 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
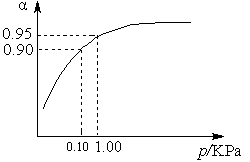
 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是焓变小于零的反应都能自发进行 |
| B.凡是熵变小于零的化学反应都能自发进行 |
| C.凡是焓变小于零,熵变大于零的化学变化都能自发进行 |
| D.CaCO3在高温下的分解反应不属于自发过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com